Relatório Consolidado
4. LEVANTAMENTOS SECUNDÁRIO E PRIMÁRIO 5.90 MB
4.3.1. Diagnóstico Regional: o município do Guarujá
4.3.2. Diagnóstico Local: a Serra do Guararu
4.3.4. Aspectos Históricos e Culturais
5. CONSIDERAÇÕES FINAIS 0.03 MB
6. REFERÊNCIAS BIBLIOGRÁFICAS 0.04 MB
ANEXO I. Vegetação 0.07 MB
ANEXO II. Mapas Temáticos da Serra do Guararu
-Mapa-Base (Articulação)
-Mapa Base folhas de 01 a 08
-Mapa Geológico
-Mapa Hipsométrico folhas de 01 a 08
-Mapa Hidrográfico
-Mapa de Vegetação folhas de 01 a 08
-Mapa de Unidades de Conservação
-Mapa de Uso e Ocupação do Solo folhas de 01 a 08
1. APRESENTAÇÃO
O Instituto Semeia, em parceria com o Instituto de Segurança Socioambiental (ISSA) e a Ambiental Consulting, firmou contrato com o FUNBIO a fim de contar com apoio técnico ao projeto “Proposta para Criação de Unidade de Conservação Pública Municipal na Serra do Guararu”, referente ao Tema 1 – criação ou ampliação de unidades de conservação públicas municipais e/ou estaduais, contemplado pelo Projeto Proteção da Mata Atlântica II – AFCOF.
Esse contrato tem por objeto a execução de estudos, levantamentos de campo e diagnóstico socioambiental na Serra do Guararu, localizada no Município do Guarujá, e posterior análise dos resultados para fundamentação de proposta para criação de Unidade de Conservação na área.
Assim, o presente produto trata do Relatório Consolidado, abrangendo os Dados Secundários e Primários, elaborado através de levantamentos bibliográficos, consultas a órgãos públicos e não governamentais e levantamentos de campo. O resultado desse processo é aqui apresentado e representa a sistematização dos dados e informações disponíveis atualmente e levantamentos realizados sobre a região da Serra do Guararu e sua área de influência. Esse relatório irá subsidiar a elaboração da proposta para criação de unidade de conservação na área. Foram levantados, compilados e sistematizados os dados, documentos, relatórios, e outros materiais e informações disponíveis sobre a área e região, incluindo as bases cartográficas que permitiram a elaboração de mapas temáticos.
2. CONTEXTUALIZAÇÃO
A Mata Atlântica é a formação florestal mais antiga no Brasil, estabelecida há pelo menos 70 milhões de anos (Leitão-Filho, 1987). Com uma abrangência praticamente contínua ao longo da região litorânea, essa vegetação resiste em apenas algumas manchas disjuntas de floresta, particularmente em locais de topografia muito acidentada.
A conservação da biodiversidade “in locu” representa, nos tempos atuais, um dos grandes desafios para o desenvolvimento sustentável frente à expansão urbana e à crescente necessidade da exploração dos recursos naturais.
Entre os vários fatores que influenciam a capacidade dos fragmentos florestais conservarem a biodiversidade destacam-se o tamanho, a forma, o grau de isolamento, o tipo de vizinhança e o histórico de perturbações (Viana et al., 1998). Esses fatores, em função das características específicas, estruturais e funcionais da sua comunidade biótica, representam variáveis importantes a serem consideradas nas propostas do manejo conservacionista.
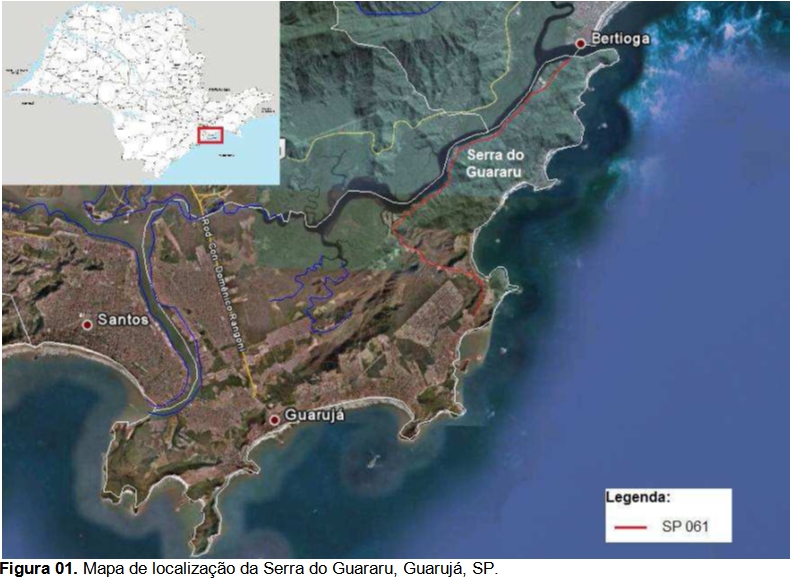
Este trabalho se desenvolve na Serra do Guararu no Município de Guarujá, situado na Ilha de Santo Amaro no litoral Central do Estado de São Paulo, na Baixada Santista. Essa região representa uma faixa quase isolada de Serra do Mar, com o oceano de um lado e o Canal de Bertioga de outro. Margeando o braço de mar predomina a vegetação de Manguezal em Bertioga, a qual finaliza no porto que separa os municípios de Bertioga e Guarujá (Figura 01).
A Serra do Guararu representa uma das últimas porções de dimensões significativas de Mata Atlântica, em bom estado de conservação, na planície costeira do litoral paulista. Constituída quase que totalmente por morros e morrotes cristalinos (migmatitos-granitos), com amplitudes topográficas variadas, declividades médias das encostas superiores de 30%, e perfis variando de convexos a retilíneos, a área destaca-se pela alta fragilidade e suscetibilidade a movimentos rápidos de massa quando ocorrem intervenções antrópicas. A cobertura vegetal predominante da Mata Atlântica cumpre um papel fundamental de proteção à frágil estabilidade das encostas, atenuando a ação do escoamento superficial, dos processos erosivos e dos movimentos de massa. As encostas servem de abrigo para muitas espécies da fauna. Além da importância da biodiversidade apresentada na região, há importantes registros arqueológicos e centenas de nascentes que alimentam o rio Iporanga, que corta a Serra do Guararu.
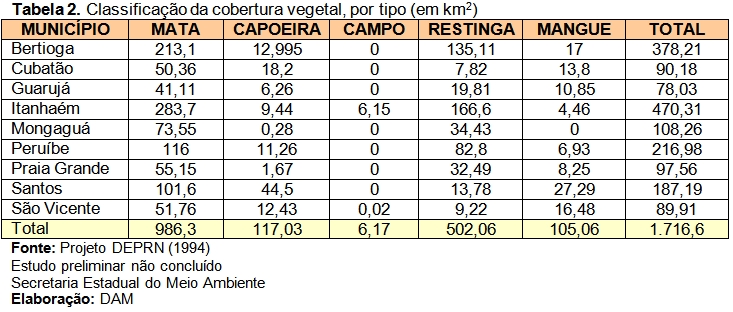
Segundo Durigan et al., 2009, essa região compreende 2.286,65 ha, coberta por 25,40% de vegetação nativa secundária. Entre as fitofisionomias estão presentes, a Floresta Ombrófila Densa Submontana e de Terras Baixas, Formação Pioneira arbustivo-herbácea sobre sedimentos marinhos recentes (restinga) e várzeas, as quais protegem 09 nascentes e 11.731 m de cursos d’água. Estão presentes perimetralmente, áreas urbanizadas (203 ha), campos antrópicos (64 ha) e agricultura perene (13 ha).
Nesse mesmo estudo, dentre as seis áreas avaliadas para o estudo de áreas prioritárias para a conservação da Mata Atlântica, a região do Rabo do Dragão foi classificada como a quinta mais favorável, tendo características importantes como a alta diversidade de formações vegetais e seu grau de conservação natural, mas desfavorecida principalmente pelo seu isolamento de outras Unidades de Conservação e, comparativamente, menor número de nascentes.
Por apresentar esses atributos, a Serra do Guararu foi tombada pela Resolução da Secretaria de Estado da Cultura n.º 48 de 18/12/92. O tombamento é um mecanismo jurídico de proteção do patrimônio cultural e natural que implica em restrições de uso para garantir a proteção e a manutenção das características da área tombada, de valor histórico, arqueológico, turístico, científico ou paisagístico (Site do SIGRH).
Dessa forma, o presente trabalho teve como objetivo o estudo dos meios físico, biótico (flora e fauna) e socioeconômico na área da Serra do Guararu, visando fornecer parâmetros indicadores capazes de subsidiar a tomada de decisão para o estabelecimento de uma Unidade de Conservação na área proposta.
3. PROCEDIMENTOS
3.1. Base cartográfica
O desenvolvimento da base cartográfica foi elaborado com vistas à produção de
mapeamento temático para subsidiar os estudos necessários aos objetivos deste projeto. Para tal, utilizaram-se as cartas planialtimétricas da Agência Metropolitana da Baixada Santista - AGEM (Folhas n° 5216; 5225; 5231; 5232; 5233; e 5234), em escala 1:10.000, produto adquirido já em meio digital e georreferenciado, fotografias aéreas de toda região de interesse, fornecidas pela Prefeitura do município de Guarujá - PMG, bem como outras fontes cartográficas oficiais, como o Instituto Brasileiro de Geografia e Estatística - IBGE e demais fontes para elaboração de mapas como geológico ehipsométrico.
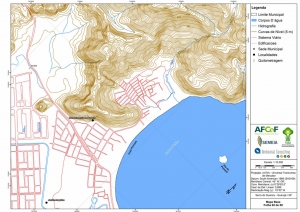
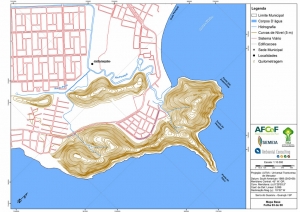
Das cartas planialtimétricas da AGEM foram selecionados alguns temas de interesse para elaboração do mapa base pertinente ao projeto. Dentre esses temas apresentam-se a hidrografia de margem dupla e de margem simples, curvas de nível com equidistância de cinco metros, sistema viário, edificações e praias. Temas gerais, como por exemplo, a divisão municipal e sedes municipais, foram extraídas de bases provenientes do IBGE.
De posse do material procedeu-se com a elaboração de uma base cartográfica única
com a utilização do módulo ArcMap, parte integrante do software ArcGis versão 9.3.x. A base foi georreferenciada ao sistema de projeção Universal Transverso de Mercator - UTM, datum South American 1969 - SAD-69 e Zona 23S. A partir de então se procedeu com a sobreposição das outras fontes cartográficas para elaboração dos mapas temáticos bem como a preparação de mosaico com as fotografias aéreas cedidas pela PMG.
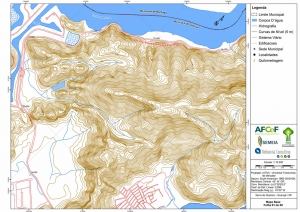
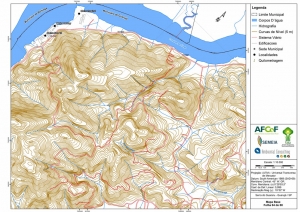
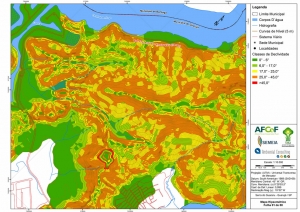
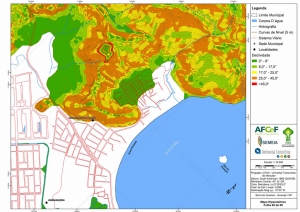
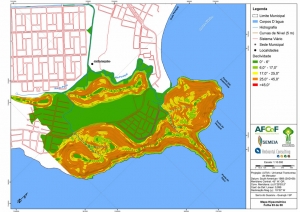
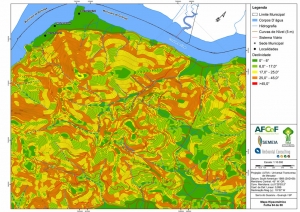
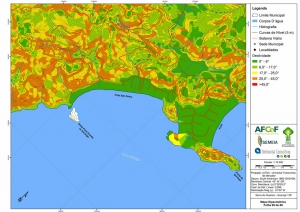
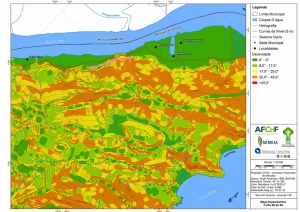
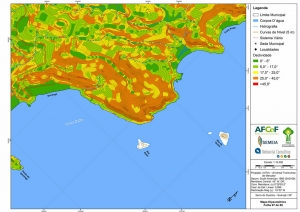
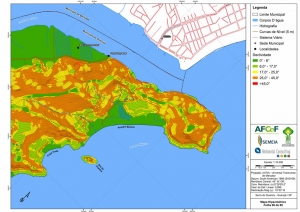
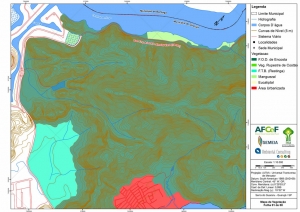
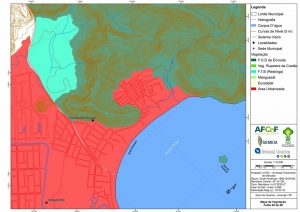
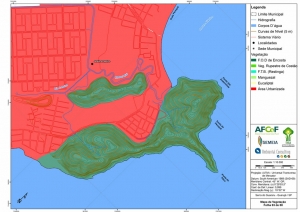
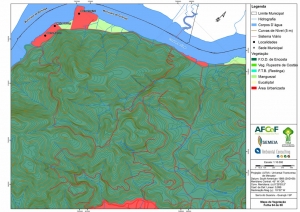
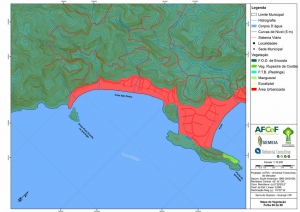
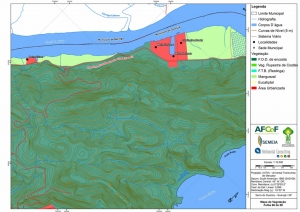
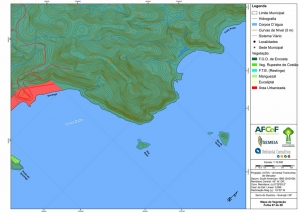
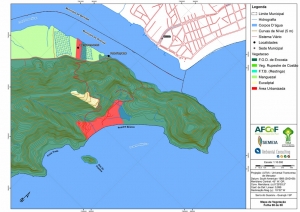
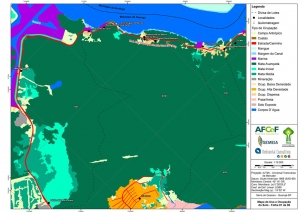
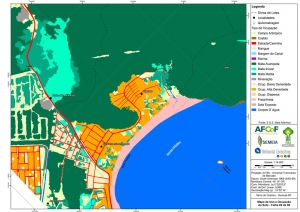
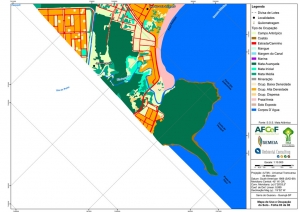
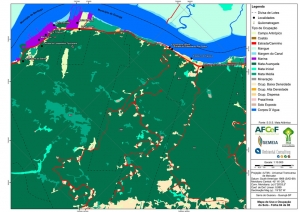
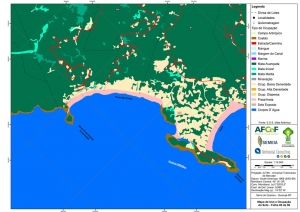
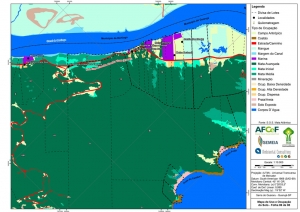
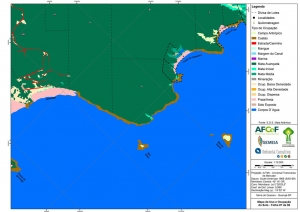
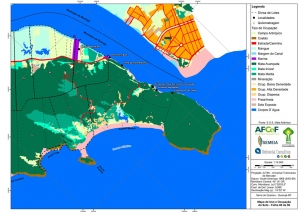
Os procedimentos acima descritos possibilitaram a produção de um mapa base (Anexo II – Mapas Temáticos), que para melhor compreensão e visualização, foi dividido em oito folhas, identificadas em um mapa de articulação específico. Essa articulação foi utilizada também para os demais temas como hidrografia, hipsometria e vegetação.
No caso do Mapa Geológico, devido a grandes áreas para caracterização, optou-se pela utilização de um único mapa em escala menor, sem que fossem prejudicadas as informações necessárias.
Com relação ao Mapa Hipsométrico, este utilizou como base as curvas de nível com equidistância de cinco metros provenientes das cartas planialtimétricas da AGEM e de ferramentas de geoprocessamento para geração das declividades. O módulo descrito acima possibilitou o cálculo automático das classes de declividade em função das curvas de nível preexistentes. Optou-se pela separação em cinco classes distintas para melhor avaliação dos pontos de possível fragilidade em função da ocupação antrópica.
3.2. Meio Físico
A caracterização do meio físico da área de interesse, envolvendo os temas de climatologia, geologia, geomorfologia, geotecnia, hidrografia e pedologia, foi elaborada através de pesquisa bibliográfica realizada em meio digital e visita à biblioteca universitária.
Em meio eletrônico foram consultadas bases de dados da biblioteca Florestan Fernandes, da Faculdade de Filosofia, Letras e Ciências Humanas, onde também ocorreu visita física, e a biblioteca digital de teses e dissertações, ambas da Universidade de São Paulo, além da biblioteca digital da Universidade Estadual Paulista e da biblioteca digital da Universidade Federal de Minas Gerais, bem como bases de dados de pesquisas científicas como Scielo Brasil e a Base de Dados da Pesquisa Agropecuária da EMBRAPA. Também serviram como referência páginas de internet que concentram conhecimento acadêmico disponível e de consulta pública como Google Livros e Google Acadêmico.
O estudo secundário das características do meio físico da área de interesse, atrelado às análises físicas da região, possibilitadas pelo uso de fotografias aéreas e ferramentas de geoprocessamento, permitiram uma abordagem ampla e completa para que se atingissem os objetivos deste estudo.
3.3. Meio Biótico
3.3.1. Vegetação
Para a revisão bibliográfica foram consultadas teses ou dissertações, trabalhos científicos publicados em revistas técnicas e livros que apresentem informações pertinentes à área em estudo. A síntese desses dados resultou numa caracterização geral das formações vegetais presentes na região.
Para se ter uma ideia do número de espécies que ocorre no município do Guarujá, foi feita uma busca no banco de dados do projeto “specieslink”. Este projeto tem por objetivo integrar a informação primária sobre biodiversidade que está disponível em museus, herbários e coleções microbiológicas, tornando-a disponível, de forma livre e aberta na Internet. A busca foi realizada no sítio www.splink.org.br, incluindo-se todas as angiospermas e pteridófitas registradas para o município de Guarujá. Os dados compilados incluem nome científico, família botânica, nome do herbário em que o material encontra-se depositado e respectivo registro numérico, além das informações gerais sobre o local de coleta.
Os registros, que continham a identificação até o nível específico, foram comparados com as listas de espécies ameaçadas de extinção no nível estadual (Resolução SMA 48, de 22 de setembro de 2004), nacional (Instrução Normativa MMA, setembro de 2008) e internacional (International Union for Conservation of Nature -http://www.iucnredlist.org/).
Para a investigação expedita de campo, foram realizadas incursões “in locu” nas áreas de diferentes formações vegetais identificadas através de observação de imagens satélites e fotos aéreas da região.
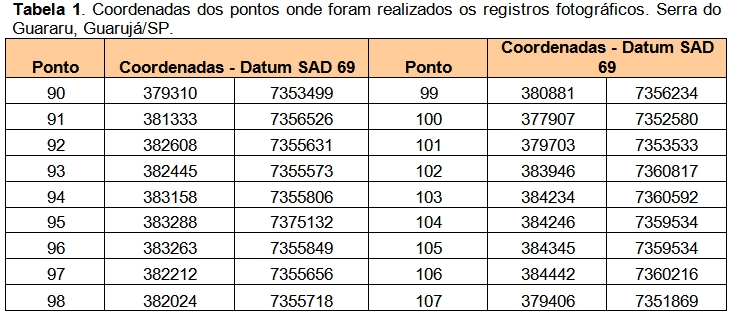
Foram escolhidos 20 pontos (Tabela 1) para a caracterização das fitofisionomias da vegetação local (Figuras 2, 3 e 4). A caracterização da cobertura vegetal foi realizada com base na Resolução CONAMA nº 10, de 01/10/1993, Resolução CONAMA nº 01 de 31/01/1994 e Instrução Normativa nº 6, de 23/09/2008, Resolução CONAMA nº 7, de 23/07/1996 e Resolução CONAMA nº 417 de 23/11/2009.
Registros fotográficos foram realizados para ilustrar a classificação da fitofisionomia em cada ponto.
Como resultado foi elaborado uma tabela com dados das espécies resultantes das observações de campo com a classificação taxonômica dos espécimes observados em cada uma das fitofisionomias (Tabela 4).
A classificação das fitofisionomias procurou acompanhar as definições dadas em publicação do IBGE, com exceções feitas à nomenclatura da fitofisionomia de Floresta de Restinga Paludosa e o Escrube presentes na legislação CONAMA nº 7 de 1996 e a Vegetação Rupestre de Costão Rochoso, assim denominadas nesta análise, com a intenção de diferenciar coberturas vegetais distintas em suas características estruturais e de riqueza específica e que não são previstas na classificação IBGE.
Em cada fitofisionomia foram registradas as espécies mais frequentes e preferencialmente indicadoras de estágios sucessionais. Não houve coleta de materiais botânicos.
Para cada espécie foram obtidas as seguintes informações: nome científico e autor, família botânica, nome popular, informações sobre endemismo e existência de interesse econômico ou medicinal. As espécies foram confrontadas com listas de ameaça de extinção no nível estadual, federal e internacional. Informações sobre bioindicadores também foram investigadas (Tabela 3).
A seguir é dada a relação das fontes das informações, citadas no parágrafo anterior, sobre as espécies.
Endemismo e Nome popular
• www. http://floradobrasil.jbrj.gov.br/2010/
Forzza, R.C.; Leitman, P.M.; Costa, A.F.; Carvalho Jr., A.A.; Peixoto, A.L.; Walter, B.M.T.; Bicudo, C.; Zappi, D.; Costa, D.P.; Lleras, E.; Martinelli, G.; Lima, H.C.; Prado, J.; Stehmann, J.R.; Baumgratz, J.F.A.; Pirani, J.R.; Sylvestre, L.; Maia, L.C.; Lohmann, L.G.; Queiroz, L.P.; Silveira, M.; Coelho, M.N.; Mamede, M.C.; Bastos, M.N.C.; Morim, M.P.; Barbosa, M.R.; Menezes, M.; Hopkins, M.; Secco, R.; Cavalcanti, T.B.; Souza, V.C. 2010. Introdução. in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro.
Ameaçadas de extinção
• Internacional – International Union of Conservation of Nature (IUCN): “The IUCN red list of threatened species”, www.iucnredlist.org/
• Federal: Instrução Normativa n0 06, de 23 de setembro de 2008
• Estadual: Resolução SMA 48, de 21 de setembro de 2004
Biondicadoras
• Resolução CONAMA Nº 1, DE 31 DE JANEIRO DE 1994
• Resolução Conjunta SMA IBAMA/SP Nº 1, DE 17 DE FEVEREIRO DE 1994
• Resolução CONAMA nº 7, de 23 de Julho de 1996
Nome popular, interesse medicinal e/ou econômico
• Lorenzi, H. 1992. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. Editora Plantarum. Vol.1: 352p.
• Lorenzi, H. 1998. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. Editora Plantarum. Vol.2. 352p.
• Secretaria do Meio Ambiente. 2005. Manual de reconhecimento de espécies vegetais da restinga do Estado de São Paulo. 439p.
3.3.2. Fauna
O documento síntese Diretrizes para Conservação e Restauração da Biodiversidade no Estado de São Paulo (Instituto de Botânica SP/FAPESP, 2008 - http://www.ambiente.sp.gov.br/cpla/files/100111_biota_fapesp.pdf) evidenciou que, apesar de ser o estado da federação com o maior conhecimento a respeito de sua biodiversidade, São Paulo ainda está muito aquém de deter toda a informação necessária para planejar detalhadamente a sua estratégia de conservação, já que carece de qualquer conhecimento faunístico e florístico para mais de 90% dos fragmentos de vegetação nativa presentes em seu território. Nesse ponto, a Serra do Guararu não é uma exceção, sendo sua biota desconhecida para vários grupos taxonômicos e apenas parcialmente amostrada para aqueles mais estudados (aves e mamíferos).
Em função da inexistência de levantamentos biológicos abrangentes especificamente direcionados para a área em questão, o presente estudo baseou-se nas informações disponíveis para as áreas adjacentes da Baixada Santista que, numa segunda etapa, foram confrontados com informações pontuais disponíveis para a Serra do Guararu, a fim de produzir um panorama geral da fauna do maciço. Três compilações de dados recentes formaram a base das informações abaixo discutidas: o documento Visão da Biodiversidade da Ecorregião Serra do Mar (WWF Brasil, 2011 - http://assets.wwfbr.panda.org/downloads/visao_conservacao_serra_do_mar.pdf), cuja base de dados (compilada pelo autor) resumiu toda a informação de ocorrência de aves, mamíferos e anfíbios da referida ecorregião disponível até 2005 e gerou mapas de distribuição potencial para uma série de espécies de vertebrados endêmicos e ameaçados de extinção; o Diagnóstico Sócio Ambiental para Criação de Unidades de Conservação no Estado de São Paulo – Polígono Bertioga (Fundação Florestal, WWF Brasil e Instituto Ekos) que compilou a informação para fauna de vertebrados (até 2008) das florestas de baixada dos rios Itapanhaú e Guaratuba e adjacências e a publicação Butterflies (Lepidoptera, Papilionoidea and Hesperioidea) of the "Baixada Santista" region, coastal São Paulo, southeastern Brazil (Francini et all. 2011), que resume a informação disponível sobre o único grupo de invertebrados bem inventariado nessa porção do estado. As listagens de fauna obtidas dos documentos citados foram comparadas com as informações disponíveis no Plano de Manejo do Loteamento Iporanga (Ambiental Consulting, 2008), para fazer uma ponderação do que ocorre ou pode ocorrer na Serra do Guararu como um todo.
3.4. Meio Socioeconômico
Para o levantamento socioeconômico, a primeira dimensão do conhecimento para a caracterização da população residente na área de estudo foi construída sobre dados secundários, isto é, sobre aqueles já existentes e publicados, como por exemplo, pelo IBGE e órgãos públicos. No caso do IBGE, este tem essas informações consolidadas por setor censitário (é a menor parte considerada no levantamento do Censo Demográfico do IBGE), que foi a base de análise. A bibliografia faltante foi levantada através de pesquisas em bases de dados virtuais e bibliotecas (como a Biblioteca do IBGE/EU/BA-SDDI – Setor de Documentação e Disseminação de Informações e a Biblioteca da Faculdade de Filosofia, Letras e Ciências Humanas da Universidade de São Paulo), em órgãos públicos (como a Prefeitura do Guarujá), em ONGs (como a Fundação SOS Mata Atlântica e ISSA) etc.
Os dados socioeconômicos existentes e previamente levantados foram então complementados por estudo de campo realizado na Serra do Guararu, e, de forma mais abrangente, na região de entorno. No estudo de campo, realizado entre 18 e 22 de outubro de 2011, foram visitadas as vilas e núcleos urbanos da região, bem como os loteamentos, condomínios e marinas, onde foram levantadas as informações socioeconômicas através de observação participante e contato com moradores e frequentadores. Foram percorridos os principais acessos, permitindo também a caracterização das formas de uso e ocupação do solo, através de observação direta e checagem das informações previamente levantadas na bibliografia e no contato com os diversos atores sociais (moradores locais, representantes de órgãos públicos e empresas privadas). O levantamento das características antrópicas, que subsidiaram a elaboração do diagnóstico socioeconômico e histórico-cultural foi, sempre que possível, auxiliado pelo georreferenciamento e mapeamento dos locais encontrados.
Buscou-se assim, a atualização e confirmação dos dados já existentes bem como o levantamento de demais informações acerca da infraestrutura e da socioeconomia local. Dessa forma, o estudo de campo abrangeu instrumentos de pesquisa etnográfica para diagnóstico rápido como entrevistas, conversas informais, interações cotidianas e observação participante.
A técnica mais sistemática para coleta de dados se deu através da aplicação de entrevistas semiestruturadas (Bernard, 2006) com lideranças locais, administradores públicos e informantes-chave. Essas entrevistas são abertas, mas seguem um roteiro pré-elaborado com os tópicos mais relevantes para o levantamento socioeconômico aqui proposto, permitindo ao mesmo tempo a inclusão de assuntos que por ventura surjam durante a conversa e que se relacionem com o escopo do estudo.
Embora as entrevistas permitam a coleta de dados de forma mais sistemática, a interação com os moradores e com os locais visitados fornecem elementos importantes para a complementação das informações levantadas. O uso das diversas técnicas disponíveis possibilita uma análise subjetiva da realidade socioeconômica, ao mesmo tempo em que permite uma análise descritiva da infraestrutura local e das formas de uso e ocupação do solo. Por fim, cada pesquisador envolvido manteve um diário de campo para narrar eventos e expressar sentimentos, impressões e ideias de uma forma mais livre e subjetiva, enriquecendo a análise das informações levantadas.
Em um primeiro momento, as técnicas de observação participante permitiram também identificar e caracterizar os principais grupos de interesse e atividades econômicas que estão diretamente relacionadas a Serra do Guararu. Assim, foram identificados os grupos de interesse primários, ou seja, aqueles que participam diretamente de atividades econômicas, tais como proprietários de terras, comerciantes e microempresários locais, agentes/serviços de turismo locais, hoteleiros/hotéis, órgãos dos governos municipais, moradores e comunidades tradicionais. Foram levantados também os grupos de interesse secundários, ou seja, aqueles que de alguma forma possuem envolvimento com as áreas de estudo: investidores, turistas, empresários e ecologistas/pessoas interessadas no valor de existência da biodiversidade local. Para cada grupo foram identificados seus principais interesses, expectativas, potencialidades, limitações e conflitos. Caracterizou-se também a composição de redes de interesses complementares aos concorrentes, a fim de identificar prováveis alianças ou conflitos.
De maneira geral, os dados coletados foram analisados de forma integrada, permitindo o entendimento dos aspectos socioeconômicos locais. O primeiro passo se deu por meio da caracterização geral da população quanto à localização, escolaridade, saúde, saneamento básico, habitação e infraestrutura.
O segundo passo abrangeu a caracterização socioeconômica com base nas formas de uso e ocupação do solo, considerando-se a situação fundiária e as atividades econômicas e de subsistência desenvolvidas e suas tendências, bem como as tecnologias empregadas nos processos produtivos, os mecanismos de incentivo disponíveis e as fontes de financiamento existentes, assim como suas destinações. As informações identificadas e analisadas sobre o uso e ocupação do solo foram mapeadas, com seus problemas ambientais decorrentes (áreas urbanizadas, desmatamentos, ocupações irregulares, remanescentes vegetais e outros) e as tendências de desenvolvimento de cada atividade. Foi considerada também no mapeamento a existência de Reservas Particulares do Patrimônio Natural (RPPN) e outras UCs existentes ou propostas, além de populações caiçaras.
Os aspectos históricos e culturais regionais também foram caracterizados, tais como a colonização, as mudanças nas formas de uso e ocupação do solo, as manifestações culturais resultantes, a presença de etnias indígenas e populações tradicionais e sua influência na cultura local. Da mesma forma, foi investigada a presença de sítios históricos, paleológicos e arqueológicos na região.
Foram levantadas outras ocorrências populares na região, incluindo práticas culturais locais, principalmente o uso tradicional da flora e fauna, festividades, atividades de turismo e feiras, mitos e lendas regionais. Foram identificadas, junto às comunidades, a possibilidade de produção artesanal e as formas de comercialização, bem como outras alternativas econômicas viáveis para a população inserida na região, de modo que possam ser compatibilizadas à preservação e ao uso sustentável dos recursos naturais.
Por outro lado, foram identificados os problemas ambientais decorrentes das diferentes formas de uso do solo e dos recursos naturais e as consequências e efeitos negativos destes sobre a região. Foram abrangidas também as consequências de outras atividades das populações locais tais como a disposição inadequada de lixo e esgoto, o desmatamento, a poluição da água e ar, entre outras. Adicionalmente, foram avaliadas as perspectivas futuras das atividades econômicas e sociais que sejam conflitantes com os propósitos de conservação, bem como a tendência de ocupação dos espaços.
O levantamento socioeconômico realizado fornecerá, dessa forma, os subsídios necessários para que seja elaborada proposta de criação de Unidade de Conservação na região, levando-se em conta aspectos fundamentais como as formas históricas e atuais de uso e ocupação do solo, bem como a identificação de potenciais corredores biológicos.
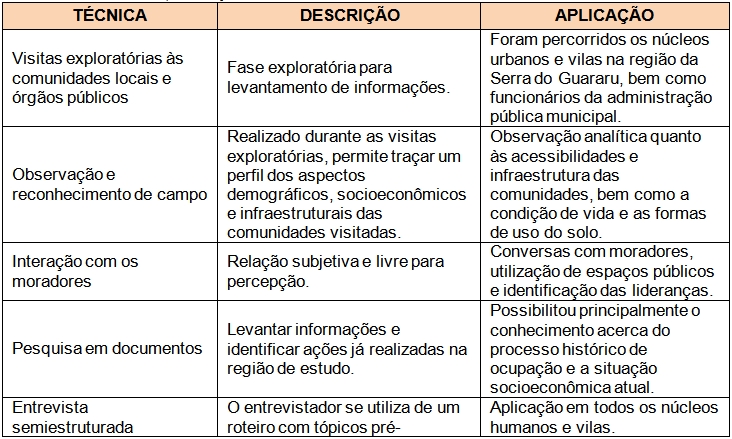
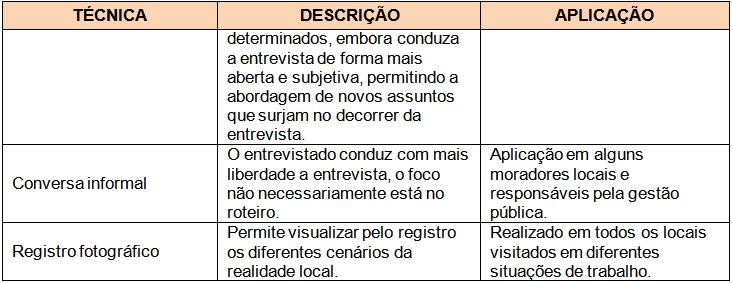
Em suma, a metodologia para a coleta de dados e informações em pesquisas qualitativas rápidas de cunho antropológico, como a utilizada nesse estudo, se deu através de diversas técnicas e ferramentas aplicadas ao maior número de sujeitos dentro de um espaço de tempo reduzido, como detalhado no Quadro 01. Não obstante, a análise dessas informações baseou-se em uma “análise de consenso”, onde os depoimentos e relatos de um sujeito são confrontados entre si para verificação da coerência do discurso, bem como entre os dos demais sujeitos da pesquisa, além da checagem com as informações disponíveis na literatura, a fim de se evitar distorções e induções por parte dos informantes e garantir uma maior verossimilidade dos dados coletados.
Quadro 01. Técnicas de pesquisa utilizadas da etapa de campo realizada em outubro de 2011 na Serra do Guararu, Guarujá.
4. LEVANTAMENTOS SECUNDÁRIO E PRIMÁRIO
4.1. Meio Físico
4.1.1. Clima
Para melhor compreensão das características climáticas da área de estudo, faz-se necessário o entendimento da caracterização da região sudeste do Brasil e da relevância da proximidade da área de interesse com a escarpa da Serra do Mar para que, dessa forma, fossem abordadas as especificidades do clima da Serra do Guararu.
A Serra do Guararu está localizada no município de Guarujá, São Paulo, região sudeste do Brasil, que se caracteriza climaticamente pela distribuição espacial e temporal da precipitação, fator ambiental de extrema importância que influencia os meios físico, biológico e socioeconômico.
Essas características derivam da situação de escoamento atmosférico e da proximidade com o oceano, sofrendo influência de fenômenos de grande escala como El Niño, La Niña, a Zona de convergência do Atlântico Sul (ZCAS) e a Zona de Convergência Intertropical (ZCIT). Cita-se como seus atributos climáticos a maritimidade e a continentalidade, que influenciam diretamente nas condições de temperatura e umidade e a topografia, que promove turbulência nos movimentos atmosféricos.
A ZCIT é considerada o sistema mais importante gerador de precipitação sobre a região equatorial dos oceanos atlântico, pacifico e indico, assim como sobre as áreas continentais adjacentes. Esta migra sazonalmente, em anos considerados normais, de sua posição mais ao norte (em torno de 14°N), durante agosto-setembro, para sua posição mais ao sul (em torno de 2°S), durante março-abril. Essa migração latitudinal relaciona-se com um ano mais chuvoso, quando seu deslocamento é mais ao sul durante o verão e com um ano mais seco, quando seu deslocamento é mais ao norte (Cavalcanti et al, 2009).
A ZCAS, associada ao escoamento convergente na baixa troposfera do sul da Amazônia ao atlântico sul-central e particularmente bem caracterizada no verão, é também um importante elemento de definição de certas situações de tempo atmosférico no sudeste brasileiro (Cavalcanti et al, 2009).
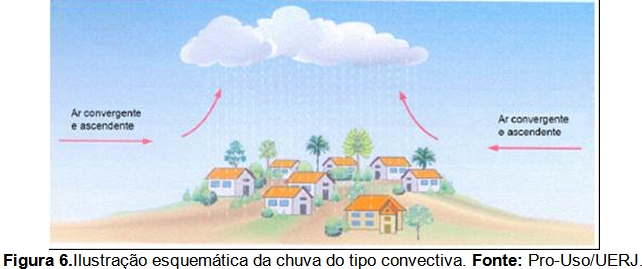
A chuva convectiva (Figura 6) é o principal tipo de precipitação que ocorre na região sudeste, reflexo de sua posição quase que totalmente intertropical. A distribuição de pluviosidade é fortemente influenciada pelos atributos geográficos da paisagem e pela dinâmica dos sistemas atmosféricos que atuam na área. A grande variabilidade inter e intra-anual estão entre as características mais marcantes do ritmo pluvial (Cavalcanti et al, 2009).
Vários centros de pressão exercem influência na região sudeste, com destaque para o Anticiclone do Atlântico Sul (AAS) associado à massa Tropical Atlântica, que tem maior domínio temporal, ele é responsável pelos tipos de tempo prevalecentes. O Anticiclone Polar (AP) também é importante e as massas polares associadas atingem a área com frequência e ao longo de todo o ano, mais marcadamente no semestre outono-inverno (Cavalcanti et al, 2009).
Registra-se, também, grande amplitude térmica, com importantes variações diuturnas, de forma mais evidente no Estado de São Paulo, chegando a oscilar até 20°C em menos de 24 horas (Cavalcanti et al, 2009).
A distribuição espacial da pluviosidade é fortemente controlada pela disposição do relevo, pela atuação das frentes polares e pela continentalidade. O oceano Atlântico garante permanente suprimento de água para evaporação, além de núcleos de condensação que, aliados ao intenso fluxo de energia solar, favorecem as precipitações através de fortes movimentos convectivos. A posição latitudinal da região favorece a exposição à radiação solar, com valores próximos a 0,37 cal/cm²/min.
A região da escarpa da Serra do Mar caracteriza-se por clima quente e úmido, com temperatura média anual superior a 22°C e pluviosidade elevada, entre 2.000 e 2.500 mm/ano. O clima da área é controlado durante quase o ano inteiro pelo Anticiclone Semipermanente do Atlântico Sul, origem da massa Tropical Atlântica, que apresenta temperatura homogênea e sofre instabilização quando entra em contato com a corrente marítima quente do Brasil. No verão o anticiclone sofre aumento de instabilidade, pois se aquece quando avança sobre o país. As atuações das frentes frias na circulação atmosférica regional têm origem, basicamente, na massa Tropical Atlântica e na massa Polar Atlântica (Menquini, 2004).
A serra do mar intercepta a penetração do ar úmido vindo do mar criando condições para as chamadas chuvas orográficas. No verão, ocorrem também às denominadas chuvas de convecção, resultantes do aquecimento terrestre (Menquini, 2004). Assim, apresenta índices anuais de chuvas de aproximadamente 4.500 mm, onde o traçado da costa é oposto aos fluxos oceânicos e àqueles provenientes do sul que, aliados à disposição da serra do mar, promovem essas alturas pluviométricas bastante consideráveis (Cavalcanti et al,2009).
Entretanto, a área é atingida, principalmente, pela chuva do tipo orográfica (Figura 7), que é causada inteira ou principalmente pela elevação de ar úmido sobre terreno elevado. Contudo, as montanhas por si só não são muito eficazes para fazer com que a umidade seja removida da massa de ar. Tais montanhas recebem mais precipitação que as áreas adjacentes mais baixas (Ayoade, 2003).
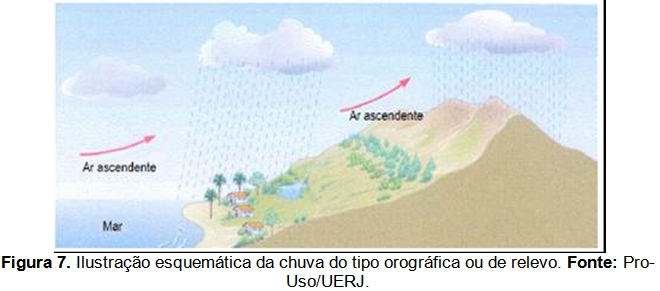
Ao se elevarem para transpor a serra do mar, os fluxos atmosféricos úmidos sofrem resfriamento adiabático e ocasionam precipitações abundantes nas áreas a barlavento da escarpa. Segundo AB Saber (2003), nas bordas do planalto atlântico paulista ocorrem os sítios de mais elevada precipitação média em todo o país (na Serra de Itapanhaú ao fundo do Canal de Bertioga, envolvendo chuvas da ordem de 4.500 mm anuais e fortes nevoeiros).
A escarpa se apresenta como uma enorme barreira às massas úmidas vindas do oceano. A precipitação média anual para um período de 30 anos mostra que o máximo de chuva está a barlavento da Serra e que há uma “região de sombra”, mais seca, a sotavento da barreira montanhosa, consistente com a direção predominante dos ventos nesta região. Os maiores totais se verificam na região da Serra do Mar na Baixada Santista, assim como os gradientes mais intensos com uma variação brusca numa pequena faixa de transição entre a serra e o planalto (Blanco, 1999).
Já Ross (2003) aponta que as médias pluviométricas mais altas aparecem no trecho paulista da serra do mar, onde se assinala a isoieta de 4.000 mm anuais na região entre Bertioga e Taiaçupeba (SP). Esse valor é comparável ao das áreas mais chuvosas do globo, como, por exemplo, a Ásia de monções.
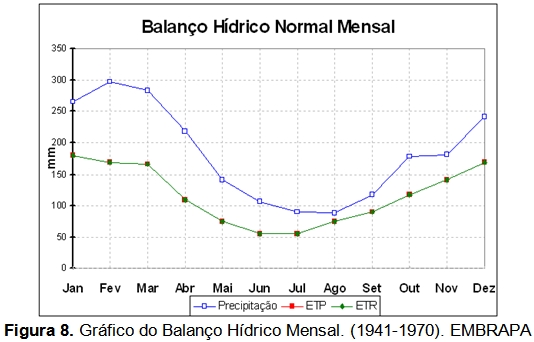
Aproximando à escala de interesse, segundo Santos (1969), o clima da região da Serra do Guararu é denominado como do tipo Af, segundo classificação do sistema climático de Koppen-Geiger. A sigla “Af” refere-se ao clima Tropical Úmido (Schimiegelow, 2009). Caracteriza-se por climas megatérmicos, temperatura do mês mais frio maior ou igual a 18°C, precipitação do mês mais seco maior ou igual a 60 mm (Figura 8), estação invernosa ausente e forte precipitação anual, bem como precipitação durante o ano todo com ausência de estação seca definida.
Ainda segundo Santos (1965), o clima, pela classificação de Thornthwaite, caracteriza-se como do tipo super-úmido mesotermal sem época seca, e na faixa a beira mar, úmido, mesotermal, sem época seca (BB´r) (Thornthwaite, 1931) (Schimiegelow, 2009).
A região sofre influência, principalmente, da chuva do tipo convectiva, que está associada às nuvens do tipo cumulus e cumulonimbus, com precipitação causada pelo movimento vertical de uma massa de ar ascendente, que é mais quente do que o meio ambiente, usualmente mais intensa que a orográfica, mas de menor duração e frequentemente acompanhada de trovões (Ayoade, 2003).
A gênese das chuvas na Serra do Guararu assemelha-se a de toda região, sendo predominantes eventos pluviométricos no período de verão, onde dominam as chuvas convectivas, que são resultantes do sobreaquecimento da superfície terrestre (originando a ascensão do ar) que, assim, arrefece e se aproxima do ponto de saturação aumentando a umidade relativa e consequente condensação e precipitação) que formam nuvens cumuliformes e tempestades locais.
Todavia, nesta estação também ocorrem chuvas frontais (chuva resultante do encontro de duas massas de ar com características diferentes de temperatura e umidade) provocadas pela advecção de ar quente (equatorial ou tropical continental), dando origem a nuvens estratiformes e chuvas mais moderadas, porém mais prolongadas. Entretanto, as chuvas mais prolongadas se originam de frentes estacionárias quando se instalam paralelas à linha da costa e à escarpa da Serra do Mar, posição essa que origina também chuvas excessivas, pois são agravadas pelo efeito da orografia (Ambiental Consulting, 2008).
Para o período de 1970-2000, segundo dados do DAEE (Departamento Estadual de Águas e Energia Elétrica) coletados no posto E3-070, localizado na Ponta da Praia (Guarujá, SP), vertente Atlântica, altitude de três metros (coordenadas 24°00’S e 46°17’W), as médias anuais de precipitação e temperatura registradas no período foram de 2.124 mm e 24,7°C respectivamente. Denotando que frequentemente o mês de janeiro é o mais chuvoso (277 mm) e agosto o menos chuvoso (91 mm) e, demonstrando as relações diretas entre pluviosidade e temperatura, tem-se também o mês de fevereiro em média como o mais quente (28,2ºC) e agosto o mais frio (20,6ºC) (Ambiental Consulting, 2008).
A temperatura máxima média é igual a 26,3°C e mínima média igual a 19,3°C, com média anual igual a 23,5°C. A pressão atmosférica média foi igual a 1.015,6 mb e a umidade relativa média igual a 75,9% e a velocidade médias dos ventos de 8,3 km/h, sendo predominantes do quadrante sul (Schimiegelow, 2009).
A precipitação pluvial anual média é igual a 2.541 mm (1957 a 1961, segundo Santos, 1965). A precipitação pluvial é maior no verão (janeiro a março) sendo menor no inverno (julho a agosto), não ocorrendo uma real estação seca. A alta umidade atmosférica e a barreira da serra do mar são as principais causas da alta pluviosidade da região (Schimiegelow, 2009).
A quantidade de luz solar apresenta variação conforme a época do ano: valores menores que 110h sol/10d de julho a outubro e superiores a 120h sol/10d no período de dezembro a maio, com picos nos meses de janeiro a fevereiro (INMET apud Lamparelli, 1995 in: Schimiegelow, 2009).
4.1.2. Geologia
A Serra do Guararu localiza-se na Ilha de Santo amaro, município de Guarujá, São Paulo, entre o oceano Atlântico e o Canal de Bertioga e a poucos quilômetros da escarpa da Serra do Mar.
Em escala menor, a área localiza-se na Província Mantiqueira, caracterizada pelos Cambissolos, que se distribuem em ambientes diversos, por praticamente todo o território nacional, sendo importantes na porção oriental dos planaltos dos estados sulistas. Os cambissolos possuem horizonte B incipiente, caracterizado pela presença de muitos minerais primários de fácil intemperização, ausência ou fraca presença de cerosidade, textura variando de franco-arenosa a muito argilosa, teor de silte, em geral, elevado e estrutura, comumente, em blocos, fraca ou moderada. Apresentam, em sua maioria, teor de argila relativamente uniforme em profundidade, possuindo gradiente textural baixo, drenagem variando de acentuada a imperfeita, podendo ser eutróficos ou distróficos (Guerra et al, 2003).
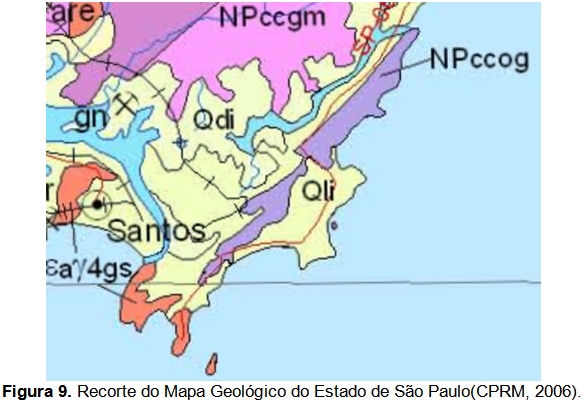
Em relação à Geologia do Estado de São Paulo, localiza-se na unidade litoestratigráfica do Complexo Costeiro (Hasui et al, 1978), que segundo o Mapa Geológico do Estado de São Paulo (CPRM, 2006), data do período Neoproterozóico. É indicado pela sigla “NPccog” e classificado como uma unidade ortognaissica, formada por ortognaisse migmatítico cálcio-alcalino, (hornblenda)-biotita granitoide gnáissico porfiróide e augen gnaisse(Figura 9). O mapa geológico elaborado para a Serra do Guararu encontra-se em anexo (Anexo II – Mapas Temáticos).
Segundo o IPT (1986), o Complexo Costeiro distribui-se em dois blocos justapostos, delimitado pela zona de falha transcorrente de Cubatão, de direção NE-SW, que limita a norte o Bloco Juquitiba, onde domina o Grupo Açungui; e a sul nas proximidades de Iguape, o Bloco Costeiro, onde domina o complexo Turvo Cajati (Paula et al,2008).
O Bloco Juquitiba é constituído por ectinitos, representados por rochas calciossilicatadas, filitos, xistos e quartzitos; migmatitos essencialmente estromatíticos e paleossoma xistoso dominante, com frequentes sinais de retrometamorfismo; e migmatitos homogêneos com neossoma dominante na forma de núcleos, semelhantes às rochas do complexo costeiro (Paula et al,2008). O Bloco Costeiro é constituído por migmatitos diversos, com predomínio de estruturas oftálmicas, ocorrendo, subordinadamente, estruturas estromáticas, agmatíticas e nebulíticas (Paula et al,2008).
A escarpa da Serra do Mar acompanha a orientação ENE das estruturas do escudo atlântico. Entretanto, em escala maior, a crista das escarpas é extremamente festonada (Ponçano et al, 1981), pois acompanha estruturas menores e falhas, além de obedecer à decisiva, embora heterógena, influência de corpos rochosos resistentes à denudação (Almeida et al, 1998).
A grande falha transcorrente pré-cambriana de Cubatão, que atravessa todo o planalto atlântico no Estado de São Paulo, com o recuo erosivo do fronte serrano, foi alcançada pela erosão remontante do rio Cubatão. A falha, na região, põe em contato rochas de diferentes resistências à erosão: metassedimentos que incluem filitos, metacalcários, xistos e quartzitos no bloco norte, e um complexo gnáissico-migmatítico-granítico ao sul. Em seu recuo erosivo a escarpa alcançou a falha e por ela se estendeu para oeste, separando a Serra do Pai Matias da escarpa principal. Seu afluente, o rio Mogi, teve idêntico desenvolvimento, acompanhando a falha para leste e separando a serra do morrão da escarpa do Cubatão (Almeida et al, 1998).
Quanto à lito-estrutura, a região está inserida na microunidade denominada Província Costeira (Almeida, 1964), e unidade morfo-estrutural denominada Baixada Litorânea. Tais unidades possuem áreas descontínuas e de pequenas dimensões, formadas por conjuntos de numerosas planícies costeiras, sendo geralmente estreitas e interrompidas por esporões da serra, além de terrenos sobre depósitos quaternários de topografia mais suave, podendo apresentar pontualmente conjunto de morros e morrotes costeiros, contínuos e extensos, com consideráveis declividades e altitudes variadas.
As planícies costeiras são superfícies geomorfológicas deposicionais de baixo gradiente, formadas por sedimentação predominantemente subaquosa, que margeiam corpos d’água de grandes dimensões como o mar e oceanos, representadas comumente por faixas de terrenos recentemente (em termos geológicos) emersos e compostos por sedimentos marinhos, continentais, fluviomarinhos, lagunares, em geral de idade quaternária (Suguiu, 2003).
São constituídas, principalmente, na maior parte do litoral brasileiro onde prevalecem condições de quiescência tectônica, a principal causa de formação das planícies costeiras ou baixadas litorâneas, pela glacioeustasia, que se refere às variações do nível relativo do mar devido aos fenômenos glaciais, isto é, de natureza climática (Suguiu, 2003).
O Canal de Bertioga, entre a ilha de Santo Amaro e o bloco costeiro cuja depressão foi causada pelo baixo nível do mar, aloja-se em uma falha antiga que separa unidades litológicas diversas do Complexo Costeiro (Almeida et al, 1998).
A ilha de Santo Amaro é caracterizada por um maciço rochoso com altitudes que variam entre o nível do mar e 300 m. Tal maciço é constituído por rochas do embasamento cristalino, de idade arqueana (4,6 – 3,0 bi anos), que sustentam relevos de morros isolados e morrotes, e por depósitos do período quaternário (2,0 mi anos), de origem continental, marinhos e mistos, que embasam os relevos de corpos de tálus, de planície alveolar, planície costeira e planície de maré (Ambiental Consulting, 2008).
O embasamento cristalino é composto por substrato rochoso constituído por granitóides oftalmíticos, gnaisses e biotitas. São rochas de granulação média a grossa, formadas por microclíneo, plagioclásio, quartzo e biotita, tendo como acessórios hornblenda, zircão, apatita, titanita e opacos (Bistrichi et al, 1981). O horizonte de alteração dessas rochas é irregular, apresentando espessuras que variam de um a oito metros, em consequência da sua posição na encosta e da presença de irregularidades do embasamento. Os solos decorrentes desta alteração são argilo-silto-arenosos, variando o teor desses elementos conforme o maior ou menor grau de granitização das rochas. Em meio a estes solos de alteração é comum à ocorrência de blocos e matacões de rocha semi-alterada (regolitos) (Ambiental Consulting, 2008).
No sopé das encostas ocorrem rampas inclinadas que constituem os corpos de tálus, formados por seixos, blocos e matacões, angulosos a sub-arredondados, com distribuição caótica no depósito, constituídos por granitóides e gnaisses semi-alterados a alterados, com matriz argilo-arenosa a areno-argilosa, e/ou rampas mais suaves, constituídas predominantemente por detritos argilo-arenosos e blocos de rochas alteradas (Ambiental Consulting, 2008).
Nos fundos dos vales e ao longo dos principais canais de drenagem, esses depósitos têm caráter colúvio-aluvionar e formam planícies alveolares. Segundo o Mapa Geológico do Estado de São Paulo (CPRM, 2006), os depósitos colúvio-aluvionares datam do período Cenozóico e caracterizam-se, na área de interesse pelas coberturas detríticas indiferenciadas e pelos depósitos litorâneos indiferenciados, identificados, respectivamente, pelas siglas “Qdi” e “Qli” (Figura 9).
A ação fluvial retrabalha o material detrítico, remove a matriz, dando origem a acumulações de blocos e de areias grossas, ricas em quartzo, feldspatos, micas e fragmentos de rocha. Os depósitos marinhos são constituídos por areias finas, constituídas por quartzo e micas, associadas a praias atuais e a cordões arenosos pré-atuais, que formam a planície costeira. Os depósitos de origem mista são representados por argila, silte (vasa) e grande quantidade de matéria orgânica, depositados nas planícies de maré que ocorrem ao longo do Canal da Bertioga (Ambiental Consulting, 2008).
4.1.3. Geomorfologia
A Serra do Guararu encontra-se no Cinturão Orogênico, sobre terreno de embasamento cristalino, no planalto Atlântico da faixa de dobramentos do ciclo brasiliano, na unidade geomorfológica dos Planaltos e Serras do Atlântico Leste-Sudeste.
Os cinturões orogênicos correspondem aos terrenos mais elevados da superfície terrestre. São áreas de grande complexidade rochosa e estrutural, geradas por efeito de dobramentos acompanhados de intrusões, vulcanismo, abalos sísmicos e falhamentos. Correspondem aos terrenos mais instáveis, nos quais prevalece forte atividade tectônica. As cadeias orogênicas encontram-se preferencialmente nas bordas dos continentes, nos limites com o oceano pacífico e índico e no mar mediterrâneo (Ross, 2003).
São os terrenos mais recentes produzidos pela tectônica e suas idades estão entre o Mesozóico e o Cenozóico, sendo que sua gênese esta relacionada com a tectônica de placas. Entretanto, os cinturões orogênicos existentes no Brasil são muito antigos, ou seja, de diversas idades ao longo do Pré-Cambriano. Essas cadeias montanhosas encontram-se atualmente muito desgastadas pelas várias fases erosivas ocorridas, mas ainda guardam aspecto serrano em grandes extensões (Ross, 2003).
Especificamente, o cinturão orogênico do atlântico estende-se desde a parte oriental da região nordeste até o sudeste do Estado do Rio Grande do Sul. É uma faixa de grande complexidade litológica e estrutural, prevalecendo rochas metamórficas de diferentes tipos e idades, como gnaisses, migmatitos, quartzitos, micaxistos, filitos, e, secundariamente, intrusivas, como os granitos e os sienitos (Ross, 2003), bem como fenolitos, calcáreos e mármores, afloramentos rochosos e latossolos vermelho-amarelos (Ross, 2009).
Os planaltos e serras do atlântico leste e sudeste, que se associam ao cinturão do atlântico, apresentam maior grau de complexidade. Sua gênese vincula-se a vários ciclos de dobramentos acompanhados de metamorfismos regionais, falhamentos e extensas intrusões. As diversas fases orogenéticas do Pré-Cambriano foram sucedidas por ciclos de erosão (Ross, 2003).
O modelo dominante do planalto atlântico é constituído por morros com formas de topos convexos, elevada densidade de canais de drenagem e vales profundos (Ross, 2003). Segundo o Mapa Geomorfológico (IPT, 1981 in Paula et al,2008), é descrito como uma região de terras altas, constituído predominantemente, por rochas cristalinas pré-cambrianas e cambro-ordovicianas, cortadas por intrusivas básicas e alcalinas mesozoicas-terciárias, e pela cobertura das bacias sedimentares de São Paulo e Taubaté.
Já a Serra do Mar originou-se de um processo epirogenético pós-cretáceo, que perdurou pelo menos até o período Terciário Médio, gerando o soerguimento da plataforma sul-americana, reavivou os falhamentos antigos produzindo a escarpa acentuada. Esta tem grande significado nesta forma de relevo, e se constitui em escarpas altas e abruptas, produzidas por grandes linhas de falhas bem mais recentes (Ross, 2003).
Ab´Saber (in: Azevedo, 1965), discute a origem e formação da serra do mar baseada nos processos de falhamentos, por volta do cretáceo e do terciário e concomitante ao soerguimento epirogênico do núcleo sul-oriental do Escudo Brasileiro, associado às efetivas influências dos fatores climáticos. O autor definiu, a partir dos escudos “pelo menos, duas fases de deformações tectônicas, para explicar a gênese da grande escarpa e dos pequenos morros costeiros regionais”. “No alinhamento principal de tais falhas restou o embrião da grande escarpa tectônica da chamada serra do mar, enquanto alguns blocos semi-isolados da área continental, mais ao sul e mais ao norte, teriam ficado em posição de ´horsts´ engastados” (Menquini, 2004).
Segundo o mesmo autor, “a partir da segunda metade do paleogeneo [...] iniciaram-se aplainações que tenderam a reduzir as irregularidades dos blocos abatidos”. Essas aplainações ocorridas por processos morfoclimáticos, associados com as direções estruturais dos gnaisses resistentes e pouco diaclasados, resultaram em dissecações relativamente pequenas e num recuo homogêneo das escarpas de falhas (Menquini, 2004).
Almeida (1953) cita o nome genérico Serra do Mar para um sistema de escarpas e montanhas que, desde o norte do Estado de Santa Catarina até o Estado do Rio de Janeiro, limita a borda do Planalto Atlântico. Diante da cidade de Santos, esse relevo atinge altitudes superiores a 1.200 m, também chamados, localmente, de serra de Cubatão (Paula et al,2008).
Ainda segundo Almeida (1953), a serra de Cubatão apresenta como feição curiosa, a forma de “pinça de caranguejo”. O autor interpretou esse relevo como resultante de intenso processo de erosão, que levou a perfeita adaptação das superfícies topográficas às diversidades de resistências das rochas. Essa feição teria sido condicionada por uma zona de falhas ou de forte flexura (Paula et al,2008).
Nesta serra são encontradas as seguintes unidades de relevo: escarpas festonadas e escarpas com espigões digitados. As escarpas festonadas são desfeitas em anfiteatros separados por espigões, topos angulosos, vertentes com perfis retilíneos. Apresentam drenagem de alta densidade, padrão subparalelo a dendrítico e vales fechados. As escarpas com espigões digitados são compostas por grandes espigões lineares subparalelos, topos angulosos e vertentes com perfis retilíneos. A drenagem é de alta densidade, com padrão paralelo-pinulado e vales fechados (Paula et al,2008).
Caracteriza também a área de interesse a Província Costeira, na qual se identifica a Baixada Litorânea. A Província Costeira, definida por Almeida (1964), corresponde “a área do Estado drenada diretamente para o mar, constituindo o rebordo do Planalto Atlântico. É, em maior parte, uma região serrana contínua, que a beira mar cede lugar a uma sequência de planícies de variadas origens”.
Na região serrana as escarpas mostram-se abruptas e festonadas, desenvolvendo-se ao longo de anfiteatros sucessivos, separados por espigões. Para compor o desnível da ordem de 800 a 1.200m, entre as bordas do Planalto Atlântico e a Baixada Litorânea, a faixa de escarpas apresenta, em planta, larguras de 3 a 5 km, em média (IPT, 1981 in: Paula et al, 2008).
Martin & Suguiu (1989) descrevem como se deram as duas fases transgressivas durante o quaternário para a Baixada Litorânea. Segundo eles, na primeira, o mar atingiu o pé da Serra do Mar, havendo deposição de areias transgressivas sobre sedimentos argilosos de origem continental. Durante a maior regressão, quando o mar encontrava-se 110 m abaixo do nível atual, os depósitos antigos foram parcialmente erodidos e, quando a transgressão de Santos ocorreu, o mar entrou nessas porções erodidas estabelecendo o sistema lagunar, na qual sedimentos argilosos foram depositados (Schimiegelow, 2009). Segundo o Mapa Geomorfológico (IPT, 1981 in:Paula et al, 2008), identificam-se as seguintes unidades de relevo: Morros isolados; terraços marinhos, planícies aluviais; mangues e planícies costeiras.
Os morros isolados apresentam topos arredondados, vertentes ravinadas de perfis convexos e retilíneos, drenagem de média alta densidade, padrão dendrítico e vales fechados. Ocorrem isolados nas planícies costeiras. São ocorrências de rochas cristalinas. Os terraços marinhos são terrenos mais ou menos planos, poucos metros acima das planícies costeiras, com drenagem superficial ausente e presença de antigos cordões (praias, dunas). As planícies Aluviais são representadas pelos sedimentos aluviais e respectivas planícies fluviais dos principais rios da baixada. Os Mangues são terrenos baixos, quase horizontais, no nível da oscilação das marés, caracterizados por sedimentos tipo vasa com vegetação típica e drenagem de padrão difuso (Paula et al, 2008).
Em grande escala, a área de interesse pode ser dividida em duas partes, segundo o Mapa Geomorfológico (RADAMBRASIL, 1983). A planície costeira que se volta para o Canal de Bertioga e o restante da região, que inclui os morros e morrotes e a parte litorânea que se volta para o oceano Atlântico.
A primeira caracteriza-se pelo domínio morfoestrutural dos depósitos sedimentares e na unidade geomorfológica da planície costeira. Apresenta-se como um modelado de acumulação fluviomarinha, identificada pela sigla “Afm”. As planícies de acumulação fluviomarinha resultam da combinação de processos de acumulação fluvial e marinha, sujeita ou não a inundações periódicas, podendo comportar rios, mangues, deltas, diques marginais, lagunas, terraços arenosos e/ou areno-argilosos (Mapa Geomorfológico, RADAMBRASIL, 1983).
A segunda área caracteriza-se pelo domínio morfoestrutural da faixa de dobramentos remobilizados das escarpas e reversos da serra do mar e na unidade geomorfológica do planalto paulistano. Apresenta-se como um modelado de dissecação diferencial, marcado pelo controle estrutural, definido apenas pela variável aprofundamento da drenagem, já que a densidade é controlada pela tectônica e pela litologia. O aprofundamento é definido pela média das frequências dos desníveis medidos em perfis transversais aos vales contidos na área (Mapa Geomorfológico, RADAMBRASIL, 1983).
4.1.4. Geotecnia
A região da Serra do Guararu apresenta-se como um terreno instável do ponto de vista geotécnico, principalmente em função dos intensos processos morfogenéticos, à ocupação em virtude de fatores naturais, como a alta declividade das encostas (conforme demonstrado no mapa hipsométrico do Anexo II – Mapas Temáticos), o aprofundamento natural dos vales fechados, bem como o alto índice pluviométrico causado, principalmente, pela grande umidade proveniente do oceano.
Segundo o Mapa Geomorfológico (RADAMBRASIL, 1983), a área classifica-se como Relevos Desnudacionais em Interflúvios e Vertentes, identificada com a sigla “EFo4”. Este apresenta dissecação extremamente forte, que englobam feições morfológicas com forte controle estrutural com escarpas festonadas, cristas, esporões e cornijas, com incisões de drenagem entre 344 m e 446 m e declividades superiores a 37°. Precipitações entre 1.200 e 2.500 mm, chegando até a 4.500 mm nos contrafortes da serra do mar. O modelado revestido por formações superficiais delgadas de textura argilosa e areno-argilosa, que por sua vez constituem a base do desenvolvimento das florestas e vegetação secundária sem palmeiras (Mapa Geomorfológico, RADAMBRASIL, 1983).
Os processos morfogenéticos atuam principalmente nas encostas desprotegidas, como desagregação mecânica e forte atuação da decomposição química. As fortes declividades estimulam constantes movimentos de massa, com deslizamentos e quedas de blocos, mesmo com presença de cobertura vegetal, como nos contrafortes da serra do mar próximo a Caraguatatuba e Ubatuba-SP (Mapa Geomorfológico, RADAMBRASIL, 1983).
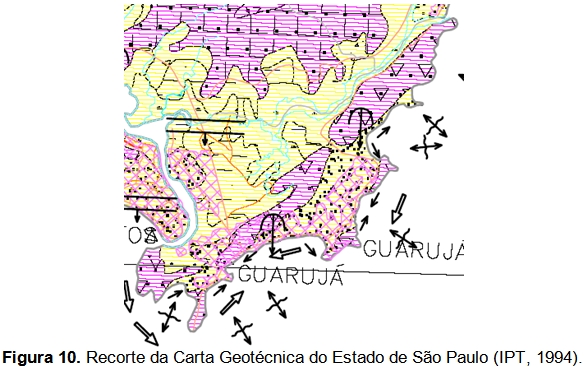
Segundo a Carta Geotécnica do Estado de São Paulo (IPT, 1994) (Figura 10), a área de interesse pode ser dividida em três partes, a saber. A parte litorânea voltada para o Canal de Bertioga, a região montanhosa e a parte litorânea voltada para o Atlântico.
As três áreas apresentam-se como terrenos de alta suscetibilidade a movimentos de massa (naturais e induzidos), nos quais os processos naturais ocorrem em suas porções restritas de relevo mais enérgico. Entretanto, o uso mais intensivo do solo nestes terrenos, associado à ausência de critérios orientativos adequados para esta ocupação, provoca maior número de ocorrências de movimentos induzidos. Os tipos diversificados de movimentos de massa presentes nesta unidade foram subdivididos em dois grupos, determinados tanto pela natureza dos fatores físicos que os condicionam, como pelo conjunto de diretrizes mais adequadas e necessárias para o seu controle preventivo e corretivo (IPT, 1994).
A região montanhosa, classificada pelo IPT como “5a”, caracteriza-se como terrenos de alta suscetibilidade a escorregamentos, naturais e induzidos, sobre rochas cristalinas de embasamento.
Os escorregamentos planares envolvendo solo, em especial os induzidos pela ocupação, são os mais importantes com relação aos problemas para o uso do solo, pois ocorrem com maior frequência e causam mais prejuízos e riscos que os demais. Esta subunidade é constituída por parte dos terrenos com embasamento de rochas cristalinas no Estado (IPT, 1994).
Manifestações significativas de problemas associados a estes processos ocorrem junto às áreas urbanas, como Mauá e Itapevi, na RMSP, e Santos, São Vicente e Guarujá, na Baixada Santista, a maioria com importantes registros históricos de acidentes com vítimas fatais e grandes prejuízos materiais (IPT, 1994).
Estes escorregamentos, quase sempre, são consequência da execução de taludes de corte e aterro mal dimensionados e desprotegidos, resultantes de movimentos de terra (terraplanagem) necessários para a implantação da maioria dos usos existente, em razão das altas declividades das encostas (IPT, 1994).
A infiltração descontrolada de água no solo também colabora no desencadeamento destes escorregamentos. Mesmo fora do período de chuvas, esta infiltração pode ocorrer a partir de vazamentos nas redes de abastecimento de água e de esgoto, das fossas e dos lançamentos de águas servidas, bem como do acúmulo de lixo e entulhos em setores críticos das encostas (IPT, 1994).
As recomendações para uso do solo nesta subunidade centram-se, portanto, no controle destas atividades, o que pode exigir mapeamentos de risco em escala de detalhe (1:10.000 ou maior) para as áreas já ocupadas (IPT, 1994).
A parte litorânea voltada para o Atlântico, classificada pelo IPT como “13”, caracteriza-se por terrenos de baixa suscetibilidade a recalques e inundações.
São terrenos de baixada litorânea constituídos por sedimentos marinhos, de textura predominantemente arenosa. Apresentam problemas de recalques sob pequenas cargas, apenas nas áreas de ocorrência de cordões litorâneos (sucessão de pequenas elevações alongadas, geralmente dispostas em paralelo, produzidas pelo recuo da linha da praia), devido à presença de argilas orgânicas moles nas depressões intercordões (IPT, 1994).
Nos terrenos arenosos, quando cargas muito elevadas são impostas (edifícios altos, pontes), recalques excessivos são registrados, em consequência do adensamento de camadas de sedimentos argilosos intercaladas às de areias em subsuperfície (IPT, 1994).
Inundações também podem ocorrer devido à ineficiência de sistemas de drenagem executados com a ocupação dos solos. A presença do nível d´água a pequena profundidade pode gerar problemas nos trabalhos de escavação nestes terrenos (IPT, 1994).
A maior parte das áreas urbanas dos municípios litorâneos assenta-se nestes terrenos. Assim, as recomendações relacionam-se aos cuidados na execução de fundações, obras de infraestrutura e drenagem (IPT, 1994).
A parte litorânea voltada para o Canal de Bertioga, classificada pelo IPT como “15”, caracteriza-se como terrenos de alta suscetibilidade a inundações, recalques, assoreamentos e solapamento das margens dos rios.
São terrenos praticamente planos, constituídos por sedimentos de textura variada, situados junto aos cursos d’água e pertencentes a planícies aluviais interiores (IPT, 1994).
Os problemas mais sérios para o uso do solo são: inundações fluviais que periodicamente atingem os terrenos situados em cotas mais baixas (várzeas); inundações pluviais que afetam também os terrenos planos situados em cotas superiores às das várzeas (terraços), quando da presença de usos mais intensivos, como urbanização; recalques excessivos e diferenciais por adensamento de argilas moles e turfosas, localizadas principalmente nas várzeas, em decorrência da aplicação de cargas elevadas e/ou rebaixamentos do nível d’água por obras civis; assoreamento dos corpos d´água por sedimentos gerados pela erosão a montante; e solapamento dos terrenos das margens de rios e córregos pela erosão fluvial (IPT, 1994).
Estes problemas ocorrem de maneira diferenciada, associados às várias características dos terrenos aluviais e suas formas de ocupação. A subdivisão desta unidade será possível em escalas de maior detalhe (IPT, 1994).
Por constituir uma feição topográfica plana, estes terrenos encontram-se bastante ocupados, onde a disponibilidade de áreas de topografia mais suavizada é mais escassa. Nestas situações, a urbanização tende a ocupar também as planícies aluviais, apesar dos problemas potenciais associados (IPT, 1994). As recomendações concentram-se nas medidas técnicas necessárias para mitigar os problemas relacionados com o uso urbano (IPT, 1994).
4.1.5. Pedologia
Os solos são parcelas dinâmicas e tridimensionais da superfície terrestre e são aqueles definidos pelos limites da ação dos agentes biológicos, químicos e climáticos. O reconhecimento dos tipos de solos pretendeu identificar e espacializar as suas diversidades, potencialidades e fragilidades, principalmente em áreas onde ocorrem intervenções antrópicas. Para tanto, utilizou-se como base o Mapa Pedológico do Estado de São Paulo, na escala 1:50.000 (EMBRAPA, 1999), e o Mapa Exploratório de Solos, na escala 1:1.000.000, folha Rio de Janeiro/Vitória – SF.23/24 (RADAMBRASIL, 1983), que apontaram a ocorrência de Cambissolos e solos Hidromórficos.
Com a forte influência que o clima exerce sobre o litoral paulista, a região da Serra do Guararu possui tipos de solos cujos processos de formação se assemelham. Os materiais originais destes solos são oriundos sumariamente de duas feições geológicas, que determinam os aspectos principais dos solos resultantes, sendo, as escarpas da serra, os maciços, os morros e morrotes de um lado, e a planície sedimentar litorânea de outro (Ambiental Consulting, 2008).
A ilha de Santo Amaro é composta predominantemente, segundo a classificação da EMBRAPA (1999) por Espodossolos (antigos podzóis), solos hidromórficos (antigos Gleissolos) e os Cambissolos. Já segundo o levantamento do projeto RADAMBRASIL, encontram-se o Cambissolo Álico, classificados como “Ca11” e o Podzol Hidromórfico, classificado como “HP”.
Os Cambissolos são solos que não possuem características bem desenvolvidas, devido ao pouco tempo de formação e a natureza do material de formação e relevo, que impediram o desenvolvimento de características típicas como o horizonte “B”. Neste caso observa-se apenas a sequência de horizontes “A-C”.
O Cambissolo Álico, “Ca11”, apresenta textura argilosa e média, fase rochosa e não rochosa moderada, escarpado, mais Latossolo Vermelho-amarelo álico de textura argilosa, relevo montanhoso, forte ondulado, ambos com horizonte “A” moderado e proeminente (RADAMBRASIL, 1983).
O Podzol Hidromórfico, “HP”, apresenta horizonte “A” proeminente e moderado, de textura arenosa, mais Areias quartzosas Marinhas distróficas com Horizonte A moderado. Ambos de relevo plano (RADAMBRASIL, 1983).
Embora ocorram afloramentos de rocha sã, principalmente nos locais de declividade elevada, as rochas estão recobertas por um manto de intemperismo espesso constituído principalmente por solo de alteração "SA", sobreposto por uma camada menos espessa de solo eluvial “SE”. Os solos originados de migmatitos e gnaisses são geralmente muito erodíveis. Apresentam coloração cinza arroxeada e granulometria variando de areia fina a média, em porções mais quartzosas até silte argiloso, nas porções micáceas. Os que possuem como rocha matriz os granitos também costumam ser erodíveis, apresentando coloração cinza amarelada e granulometria em geral mais grossa que a do “SA” de migmatito. O “SA” de quartzito é menos espesso, apresenta textura arenosa e coloração mais clara, variando de branca a amarela clara (Ambiental Consulting, 2008).
Os solos hidromórficos são aqueles que se desenvolvem sob a influência de lençol freático alto e, portanto, estão em maior parte do tempo saturados com água. Fato recorrente em regiões de clima úmido, topografia plana e adjacências de rios, lagos e planícies marinhas (Ambiental Consulting, 2008).
A porção territorial correspondente a Serra do Guararu possui Cambissolos até os limites com o canal de Bertioga e planície marinha, onde estão assentados solos hidromórficos. A ocorrência destes solos está estreitamente ligada a variações em distintos níveis topográficos. Nas áreas de vertentes (morros e morrotes) os cambissolos predominam, pois correspondem a solos pouco profundos, não hidromórficos e com horizonte “B” incipiente, pois, são solos originados pelo intemperismo de granitóides e gnaisses (Ambiental Consulting, 2008).
Nas áreas de planície costeira ocorrem solos hidromórficos, sendo que os perfis destes solos indicam um horizonte "A" com 20 cm a 30 cm de espessura, bruno escuro, estrutura granular média ou grande. O teor de argila é sempre elevado, pois frequentemente estão associados e sob a influência de solos oriundos de aluviões e mangues. Na linha de praia têm-se depósitos de areia (grãos de quartzo), clastos (fragmentos de rochas sedimentares desagregados) e conchas bem selecionados e laminados (Ambiental Consulting, 2008).
4.1.6. Hidrografia
A partir de uma abordagem em pequena escala, a região insere-se na bacia hidrográfica do Atlântico Sudeste, que compreende 224.000 km² e estende-se de São Paulo até o arroio Chuí, e os rios formam pequenas redes de drenagem que lançam suas águas diretamente no oceano atlântico. As isoietas médias anuais (1931-1988) mostram valores crescentes de sul para norte entre 1.200 a 1.600 mm e a precipitação média (1961-1991, DNAEE) é de 1.349 mm/ano. O regime fluvial dominante é temperado, perene, com tendência de enchentes no inverno e vazantes no verão. A vazão média anual é de 4.300 m³/s e a vazão média específica atinge o valor de 19,2 L/s/km² (Guerra, 2003).
Aproximando a escala para análise da Baixada Santista, esta apresenta rios curtos e torrenciais até a chegada à planície, quando então mudam de regime, podendo-se definir dois tipos de rios. O primeiro deles são os que possuem suas nascentes na serra do mar, possuindo vales que separam esporões, nascendo, assim, torrenciais. O outro tipo são os rios de pequeno curso, praticamente de planície (Schimiegelow, 2009).
As sub-bacias que lançam suas águas no sistema estuarino de Santos apresentam vazão média de 40,37 m³/s. Entretanto, a ilha de Santo Amaro só contribuiu para esse sistema estuarino em sua face oeste (Schimiegelow, 2009).
Segundo o Fundo Estadual de Recursos Hídricos (FEHIDRO), a ilha está localizada na Unidade de Gerenciamento de Recursos Hídricos N°07 (UGRHI07) da Baixada Santista. Tal unidade abrange administrativamente além do município de Guarujá, Bertioga, Cubatão, Santos, Itanhaém, Mongaguá, Peruíbe, Praia Grande e São Vicente (Ambiental Consulting, 2008).
Os principais cursos d’água, cujas sub-bacias integram esta UGRHI são: rio Itanhaém, Cubatão, Perequê, Mogi e Quilombo. O Canal de Bertioga, delimitado pelo continente e pela ilha de Santo Amaro estende-se por 24 quilômetros, sendo sua desembocadura ao sul o complexo estuarino da Baía de Santos e ao norte mar aberto (Barra de Bertioga). O rio Itapanhaú é o principal tributário do canal, além dos rios Trindade e Diana (Ambiental Consulting, 2008).
A rede de drenagem da região da Serra do Guararu apresenta padrão dendrítico, ou seja, rios ramificados irregularmente em várias direções (ver mapa de hidrografia do Anexo II – Mapas Temáticos). Os cursos d’água são sobremaneira intermitentes, alimentados por eventos pluviométricos regulares em períodos que ultrapassam os 1.500mm em 120 dias (12,5 mm/dia-DAEE) e lençóis freáticos de fluxo constante (Ambiental Consulting, 2008).
Comumente nas áreas de planícies (alveolar e costeira) o lençol freático é raso e tangencia ou corta a superfície do terreno. Nos morros e morrotes o lençol encontra-se abaixo do contato do solo com a rocha. A água de infiltração caminha sobre este contato ou pelas fraturas do maciço rochoso, aflorando em inúmeros pontos, gerando nascentes, afloramentos ou bicas (Ambiental Consulting, 2008).
Os períodos de maior pluviosidade estão frequentemente entre os meses de janeiro e março (atingindo o acumulado de mais 700 mm), eventos estes que tendem a dinamizar a recarga de aquíferos e aumentar o fluxo dos canais de drenagem.
Esses canais são formados em ambientes de sedimentos grosseiros e em grandes quantidades (granitos e migmatitos). As deposições destes sedimentos formam obstáculos naturais, fazendo com que o rio se ramifique em inúmeros canais, muitos pequenos, rasos e desordenados, devido às constantes migrações de ilhotas. A planície de inundação está sujeita, quando da diminuição do fluxo, ao abandono, ocasionando o estabelecimento de terraços parelhados de distribuição assimétrica em ambas as vertentes, ou em terraços isolados, denominados terraços fluviais (Ambiental Consulting, 2008).
4.1.7. Conclusões
A partir do exposto sobre os temas supracitados pode-se concluir a extrema importância da ampliação dos mecanismos de proteção e controle da área de interesse, tanto em função de sua significância ambiental quanto em função de sua extrema fragilidade frente às ações antrópicas.
A Serra do Guararu apresenta-se cercada pelo oceano Atlântico e pelo Canal de Bertioga, mas ao mesmo tempo, a estrada que margeia o canal permite acesso relativamente fácil até o morro próximo à Prainha Branca. Assim, a região torna-se extremamente suscetível à ação antrópica podendo resultar em danos ambientais de grande significância, como por exemplo, o avanço antrópico sobre as áreas de restingas e manguezais. A ocupação humana da região não se apresenta apenas como risco ambiental, mas também como risco ao próprio Homem, uma vez que as características geográficas da Serra a definem como um ambiente extremamente suscetível à erosão e movimentos de massa. Tais eventos tem sido a causa de grandes perdas de vidas humanas.
As altas declividades e o alto índice pluviométrico, propiciado pela proximidade com o oceano Atlântico, que fornece abundância de umidade, tornam a região instável do ponto de vista geotécnico e de alto risco à ocupação humana. Assim, toda e qualquer ocupação deve ser monitorada, estudada e avaliada sob aspectos ambientais e sociais visando tanto a manutenção do ecossistema quanto a preservação da vida humana.
4.2. Meio Biótico
4.2.1. Vegetação
O Domínio Fitogeográfico da Mata Atlântica compreende formações vegetais do Bioma da Floresta Atlântica (Floresta Ombrófila Densa), do Psamobioma da Restinga (Floresta Ombrófila Densa de Terras Baixas, Escrube, Vegetação entre cordões, Vegetação de dunas e Vegetação de praia) e de ecossistemas associados como Manguezal e Vegetação rupestre dos Costões Rochosos.
A Serra do Guararu abrange várias fitofisionomias, entre elas: a Floresta Atlântica de Encosta, formações da vegetação de Restinga, vegetação em Costão rochoso e de Manguezal, como mostram os estudos preliminares do DEPRN (1994), sendo a maior parte de Mata. Observa-se também que o Município de Guarujá é o que apresenta, dentro da região da Baixada Santista, a menor porcentagem interna de área com cobertura vegetal nativa conservada.
4.2.1.1. Formações Vegetais da Região Estudada (IBGE – Veloso, 1991)
• Floresta Ombrófila Densa Submontana (Mata Atlântica de encosta)
Formação de fanerófitos com alturas aproximadamente uniformes, poucos nanofanerófitos, com a presença de palmeiras de pequeno porte e lianas herbáceas em maior quantidade. Distinguem-se pelos fanerófitos de alto porte sendo que alguns ultrapassam 30 metros de altura.
• Floresta Ombrófila Densa de Terras Baixas (Restingas)
Ocupa em geral as planícies costeiras, nos terrenos quaternários, em geral situados acima do nível do mar nas planícies formadas pelo assoreamento, devido à erosão existente nas serras costeiras e nas enseadas marítimas. Nesta formação dominam duas “ochlospécies”, sendo uma delas a Calophyllum brasiliense a partir do Estado de São Paulo para o sul.
• Formação Pioneira sobre sedimentos marinhos e várzea (Restinga-praia)
Caracteriza-se pela vegetação em constante sucessão, de terófitos, criptófitos, hemicriptófitos, caméfitos e nanofanerófitos. Vegetação de primeira ocupação de caráter edáfico, que ocupa terrenos rejuvenescidos pelas seguidas deposições de areias marinhas nas praias e restingas e os aluviões fluvio marinhos nas embocaduras dos rios.
4.2.1.2. Descrição das formações vegetais
• Vegetação de Mata Atlântica e Mata de Restinga (Floresta Ombrófila Densa)
Destacada como “Hot Spot”, a Mata Atlântica possui atualmente de 11,4% a 16% de sua área original (Ribeiro et al., 2009), em função de perturbações de origem antrópica.
Segundo Siqueira (1994), a Mata Atlântica é um dos ecossistemas florestais mais diversificados do país sendo sua conceituação bastante diversa. Por alguns autores é definida como a vegetação restrita aos limites da faixa litorânea (Mata Atlântica de Encosta), ou por outros até admite a penetração desta formação vegetal para o interior, na região Sudeste, principalmente quando se refere ao estado de São Paulo.
Seguindo a abrangência estabelecida pela CMA (1992) a Mata Atlântica localiza-se na Serra do Mar, Geral e Mantiqueira e, no caso de São Paulo, também na parte leste do Planalto Atlântico.
Desse modo, a floresta atlântica (sul/sudeste) é composta por três formações distintas: a mata das planícies litorâneas, a mata de encosta e a mata de altitude. A elevada riqueza e diversidade da Floresta Atlântica de Encosta descrita nos vários estudos de florística e fitossociologia estão correlacionadas à riqueza de habitats distribuídos pela extensa área coberta por essa formação vegetal. Mesmo assim, segundo estudo de Tabarelli e Mantovani (1999) realizado na Floresta Atlântica de Encosta no Estado de São Paulo, a grande importância dada à conservação da Mata Atlântica no Brasil deve-se aos níveis de endemismo e não à riqueza total de espécies em diferentes escalas.
No estudo de Siqueira (1994), para a vegetação de Mata Atlântica, no seu senso lato, a listagem florística observada nos 63 levantamentos florísticos e fitossociológicos analisados resultou em 1380 binômios que, agrupados pela distribuição espacial predominante, distinguiu dois grandes grupos de riqueza florística, o do nordeste e o do sudeste/sul.
Considerada a que possui maior quantidade de estudos realizados, a região sudeste foi a que apresentou maior riqueza de espécies, gêneros e famílias identificadas. Neste estudo, as espécies de maior ocorrência foram Tapirira guianensis Aubl. (Anacardiaceae) e Guapira opposita (Vell.) Reitz, ambas com 52% de ocorrência. O gênero de maior ocorrência foi Ocotea (Lauraceae) e a família de maior distribuição foi Lauraceae.
Segundo Lacerda (2001), em seu estudo considerando apenas a vegetação da Serra do Mar, a composição florística e a estrutura da vegetação arbórea sofrem variações que acompanham as alterações altitudinais, distinguindo-se, na área de Picinguaba-SP, em: Floresta de Meia-encosta (100-600 m), Floresta do Alto do Morro (1000 m) e Floresta de Planície (2 m). Neste estudo, as famílias Myrtaceae e Arecacea só não foram as mais importantes na altitude de 1000 m. As espécies Schefflera angustissima, Garcinia gardineriana e Campomanesia guaviroba foram presentes em todo o gradiente altitudinal.
Do mesmo modo, em seu estudo, na Mata Atlântica - senso restrito, Urbanetz (2010) encontrou diferenciação nítida entre a composição e distribuição da abundância de espécies da floresta da encosta e a da floresta da planície mesmo com a ocorrência de espécies comuns entre as formações.
A composição florística e a estrutura da floresta de encosta foi mais uniforme que a da planície. Nota-se, entretanto, que a floresta de encosta analisada neste estudo não abrangia as mesmas variações altitudinais consideradas no trabalho de Siqueira (1994).
No caso da floresta de encosta, as variações não mostraram correlação significativa com alterações ambientais e que, desse modo, podem estar relacionadas com variações nos níveis de influências antrópicas, por exemplo. No caso da planície, a maior variabilidade na composição florística e na estrutura teve maior correlação com variáveis ambientais e deve estar correlacionada à proporção de areia no solo da planície.
No estudo de Pteridófitas realizado no Forte dos Andradas – Guarujá/SP, nos remanescentes da Floresta Atlântica de Encosta, Boldrin e Prado (2007) amostraram 17 famílias, 33 gêneros, 69 espécies e 5 variedades. Das espécies neotropicais, 15 são endêmicas do Brasil, sendo quatro bem distribuídas no território nacional, três apenas na costa leste e oito restritas às regiões Sul/Sudeste. Entre as famílias amostradas destacam-se Pteridaceae com 11 spp. e Polypodiaceae (10 spp.), seguidas de Thelypteridaceae (6 spp.), Cyatheaceae e Hymenophyllaceae (5 spp. cada). Os gêneros com maior número de espécies foram Cyathea, Trichomanes e Thelypteris (5 spp. cada), seguidos de Blechnum, Campyloneurum e Pteris (4 spp. cada).
Distintas principalmente em função do substrato em que se desenvolvem organismos da flora das Florestas Ombrófilas Densas Submontanas, Montanas e Altomontanas são passiveis de alcançar os ambientes das Florestas Ombrófilas Densas de Terras Baixas proporcionando a ocorrência de espécies comuns a essas duas formações.
Face às inúmeras denominações e descrições confusas e equivocadas para a vegetação que cobre a região da planície a qual se estende pelo litoral paulista, Souza et al. (2008) sugerem a utilização de “Vegetação de Planície Costeira e Baixa a Média Encosta” em substituição a denominação de Vegetação de Restinga, principalmente em função da análise das diferentes características geomorfológicas das áreas consideradas para as restingas, reconhecendo, no entanto, as variações dos tipos de vegetação que ocorrem nos diferentes ambientes assim localizados. Os tipos de vegetação ocorrentes são a Floresta Alta de Restinga, Floresta Baixa de Restinga, Floresta Paludosa de Restinga, Escrube de Restinga e Vegetação de dunas, que dependem mais das características do solo do que do clima, principalmente do regime de águas dos solos predominantemente arenosos e pobres em nutrientes.
Na floresta de Planície, além das famílias Myrtaceae e Arecaceae, destacaram-se também pela sua importância as famílias Bignoniaceae, Meliaceae, Clusiaceae e Euphorbiaceae. Complementando, outro estudo como de Martins et al. (2008),também indica a família Myrtaceaecomo a de maior riqueza específica e, entre as espécies consideradas comuns, citam Amaioua intermedia, Andira fraxinifolia, Calophyllum brasiliense, Clusia criuva, Eugenia stigmatosa, Guapira oposita, Ilex theezans, Ilex dumosa, Maytenus robusta, Myrcia multiflora, Nectandra oppositifolia, Ocotea pulchella, Pera glabrata, Psidium cattleyanum, Tabebuia cassinoides e Tapirira guianensis.
Remanescentes bem preservados de Floresta Baixa de Restinga e Floresta Alta de Restinga são encontrados principalmente em Ubatuba, restando aproximadamente 10% do bioma original no estado. Estudos descritivos, mais recentes, desta vegetação na Baixada Santista são escassos (Souza, 2008), alguns realizados em Bertioga por Guedes e Silva (2003), Guedes e Silva et al. (2006), Lopes (2007), Souza et. al. (2008), Martins et al. (2008) e Miyazaki (2009).
A Floresta Paludosa de Restinga representa uma comunidade vegetal que se diferencia na Floresta Ombrófila Densa de Terras Baixas por ocupar espaços frequentemente ou permanentemente inundados e, desse modo, compreender espécies mais tolerantes às características diferenciadas desses solos encharcados.
O Escrube da vegetação de restinga representa a fisionomia arbustiva da colonização desenvolvida geralmente após a região das dunas fixas em cordões arenosos, precedendo as fisionomias florestais. Apresentam predominância de espécies xeromórficas herbáceas e arbustos formando vegetação densa, sob influência de borrifos marinhos. Em estudo realizado na região norte de Bertioga, Martins et al. (2008) foram identificados na região mais próxima à praia, a vegetação composta por espécies herbáceas, arbustivas e arbóreas nanificadas, com predominância de Ananas fritzmuelleri, Bromelia antiacantha, Cordia curassavica, Dalbergia ecastaphyllum, Epidendrum fulgens, Guapira opposita, Heteropterys aenea, Heteropterys intermedia, Lantana undulata, Mikania micrantha, Paullinia micrantha, Psidium cattleyanum, Quesnelia arvensis, Schinus terebinthifolius, Smilax elastica, Sophora tomentosa, Tetracera sellowiana e Tibouchina clavata. Em direção ao interior, a vegetação torna-se mais alta, com espécies arbustivas e pequenas árvores, como Eugenia speciosa, Guapira opposita, Maytenus littoralis, Psidium cattleyanum, Schinus terebinthifolius e Tocoyena bullata.
Os estágios sucessionais da Vegetação de Planície Costeira e Baixa e Média Encosta (Vegetação de Restinga) são descritos na Resolução CONAMA nº 07 de 1996. Assim como os estágios sucessionais definidos para a vegetação de Mata Atlântica constam na Resolução CONAMA nº 01 de 1994.
• Vegetação de Manguezal (ecossistema associado à Mata Atlântica)
O ecossistema de manguezal se desenvolve em áreas litorâneas tropicais. Ocorre em terrenos baixos, planos, em regiões estuarinas, às margens de lagunas ou ao longo de rios e canais naturais, até onde ocorre o fluxo das marés.
A cobertura vegetal é constituída de poucas espécies vegetais lenhosas típicas (angiospermas), além de micro e macro algas (criptógamas) adaptadas à flutuação de salinidade e caracterizadas por colonizarem sedimentos predominantemente lodosos, com baixos teores de oxigênio (Schaeffer-Novelli, 1991).
As espécies lenhosas de manguezais mais comuns são Rizophora mangle, Aviceniashaveriana e Laguncularia racemosa. Podem ser encontradas, também, espécies tolerantes à salinidade como as dos gêneros Hibiscus, Terminalia, Thespesia, Erithrina e Casuarina (Vannucci, 1999). A gramínea Spartina sp. é outra espécie comum nos manguezais, com adaptações estruturais para se desenvolver em ambientes anóxicos.
Além da vegetação pouco diversa e específica desse ecossistema extremamente dinâmico, os manguezais apresentam funções ecológicas importantes como“purificação e armazenamento de água, proteção contra tempestades, estabilização das condições climáticas locais, recarga e descarga de aquíferos, retenção de contaminantes como o Hg; e valores, como base de cadeias alimentares estuarinas e marinhas, oferta de recursos de flora e fauna e possibilidades de turismo e recreação são desempenhados e gerados “gratuitamente” pelos manguezais” (Cunha-Lignonet al., 2009).
De acordo com os estudos de Rodrigues et al. (1995) e Cunha-Lignonet al. (2009) os manguezais do canal de Bertioga classificaram-se entre aqueles da Baixada Santista, como dos ecossistemas menos degradados em função da robustez e densidade da vegetação encontrada.
No entanto, atualmente em função do crescente avanço das áreas residenciais e das marinas, além do lançamento acidental de óleos e produtos tóxicos derivados do petróleo, essa formação vegetal apresenta-se em processo de fragmentação e diminuição da sua área de cobertura original. Ainda, na Ilha de Barnabé, Baixada Santista, a construção da rodovia e ferrovia, acrescentada à expansão portuária e retificação do canal, provocaram perda de extensas áreas de manguezais por aterros, alagamentos, cortes de vegetação e alteração da hidrodinâmica local (Cunha-Lignonet al., 2009).
A Baixada Santista possui 105,06 km2 de área coberta por manguezais sendo que 10,85 km2se encontram no Município de Guarujá (São Paulo, 2000). Nesse estudo, Cunha-Lignonet al. (2009) verificaram a destruição de 107,3 ha de área de manguezal da margem da Ilha de Santo Amaro, o qual perfez a eliminação de 78,4% da cobertura de manguezal original.
• Vegetação de dunas
Segundo a definição constante na Resolução CONAMA nº 07/1996, a vegetação de dunas e praias, caracterizam-se como vegetação “em constante e rápido dinamismo, mantendo-se sempre como vegetação pioneira de primeira ocupação (clímax edáfico), também determinado por marés, não sendo considerados estágios sucessionais”.
Em área posterior à zona entre marés, surgem plantas herbáceas providas de estolões ou de rizomas, em alguns casos formando touceiras, com distribuição esparsa ou recobrindo totalmente a areia, podendo ocorrer a presença de arbustos chegando em alguns locais a formar maciços; o estrato herbáceo é predominante apenas nas dunas.
Nesta mesma definição são elencadas como espécies indicadoras: Blutaparon portulacoides, Ipomoea spp, timutu ou pinheirinho-de-praia (Polygala cyparissias), carrapicho-de-praia (Acicarpha spathulata); gramíneas (Panicum spp, Spartina spp, Paspalum spp), grama-de-praia (Stenotaphrum secundatum), carrapicho (Cenchrus spp), ciperáceas (Androtrichum polycephalum, Fimbristylis spp, Cladium mariscus), acariçoba (Hydrocotile bonariensis), cairussu (Centella asiatica) e ascactáceas (Cereus peruvianus, Opuntia monoacantha). Se houver ocorrência de arbustos, asespécies geralmente são: camarinha (Gaylussacia brasiliensis), canelinha-do-brejo (Ocotea pulchella), caúna ou congonhinha (Ilex theezans), Dodonaea viscosa, feijão-de-praia (Sophora tomentosa), Erythroxylum amplifolium, pitanga (Eugenia uniflora), araçá-de-praia (Psidium cattleyanum), maçazinha-de-praia (Chrysobalanus icaco);
• Vegetação rupestre
Ocupam ambientes marcados por fatores de estresse ambiental como a alta influência da salinidade, elevadas temperaturas no substrato, pouca quantidade de solo e matéria orgânica.
Em estudo realizado na Ilha dos Franceses – ES, Ferrera, et al. (2007) encontraram significativa cobertura vegetal em ambientes rupestres, onde se destacaram as famílias Asteraceae (6 spp.), Bromeliaceae (4 spp), Cactaceae (4 spp), Fabaceae (2 spp) e Poaceae (2 spp).
Condições relacionadas à declividade do substrato e consequentemente da sua capacidade de acúmulo de nutrientes influenciaram a distribuição das espécies encontradas nesse trabalho. Na região de menor declividade foram amostrados os espécimes de Asteraceae e as espécies Centrosema virginianum, Cordia curassavica, Cyperus ligularis, Lasiacis ligulata e Sida carpinifolia, além das lianas Centrosema virginianum, Ipomoea cairica, Oxypetalum bankzsiie, Vanilla sp. na transição com as formações adjacentes. O cacto Cereus fernambucensis foi encontrado nas “ilhas de vegetação” e regiões de transição, onde pode ocorrer juntamente com Selenicereus setaceus. As bromélias foram representadas por Aechmea lingulata, Bromelia antiacanthae, Quesnelia quesneliana.
Já na região de maior declividade, não existem as “ilhas de vegetação”. A vegetação que ocorre encontrava-se na borda das outras formações e apresentaram um menor número de espécies. Foram encontradas as bromélias Aechmea lingulata, Neoregelia pascoalianae, Vriesea procera desenvolvendo-se sobre o costão rochoso na borda da formação arbustiva. Destacaram-se também nesta face Cereus fernambucensis e Furcraea foetida.
• Vegetação Secundária
Considera-se vegetação natural secundária aquela desenvolvida a partir da regeneração da cobertura vegetal onde houve algum tipo de perturbação naquela estabelecida primariamente, e que se estabelece através de processos sucessionais.
A sucessão secundária em Mata Atlântica está descrita, em norma federal, a Resolução CONAMA nº 10/1993 que descreve fito-fisionomicamente os estágios sucessionais para o Estado de São Paulo, e a Resolução CONAMA nº 01/1994 que define as características da vegetação em seus estágios sucessionais primário, secundário inicial, médio e avançado de regeneração a fim de orientar os licenciamentos no Estado.
voltar ao topo
4.2.1.3. Número de espécies
A Tabela 1 do Anexo I mostra os 216 registros compilados a partir do banco de dados do “specieslink”. Destes, apenas 159 encontram-se identificados até o nível de espécie, somando 114 espécies e 43 famílias, incluindo ervas, arbustos, árvores, lianas e epífitas.
Desses registros destacaram-se quatro espécies, pelo grau de ameaça de extinção para o Estado de São Paulo, conforme Tabela 3 abaixo.
Tabela 3. Espécies ameaçadas de extinção registradas no Guarujá (SP). EN: em perigo, EX: presumivelmente extinta; VU: vulnerável.
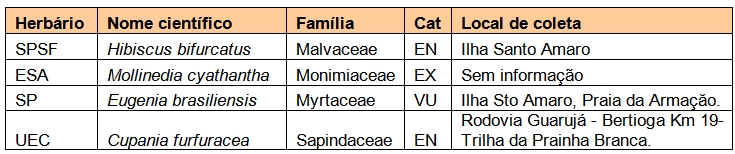
Hisbiscus bifurcatus é arbustivo enquanto que as demais são arbóreas. Excetuando-se Mollinedia cyathantha, que presumivelmente encontra-se extinta, as demais foram coletadas na Ilha de Santo Amaro.
Além destas, provavelmente ocorrem outras espécies ameaçadas, principalmente com outras formas de crescimento como epítitas e herbárceas, que são menos coletadas comparando-se com as espécies arbóreas. A falta de identificação desses materiais no nível específico, mesmo depositados em herbários, é outro fator que dificulta a catalogação (registro) de espécies ameaçadas para uma determinada região.
voltar ao topo
4.2.1.4. Resultados do levantamento de campo
Através do levantamento de campo realizado, foram identificadas 8 fitofisionomias na vegetação: Floresta Ombrófila Densa Médio e Baixo Montana, Floresta Ombrófila de Terras Baixas (Floresta de Restinga), Floresta de Restinga Paludosa, Escrube de Restinga, Manguezal, Vegetação de Dunas e Vegetação Rupestre de Costão Rochoso (ver mapa de vegetação do Anexo II – Mapas Temáticos).
A Floresta Ombrófila Densa é a formação vegetal de maior cobertura ocupando quase a totalidade da área analisada. O estágio sucessional de regeneração predominante é médio/avançado, com estratificação vertical nítida, presença de serapilheira úmida, presença de epífitas como orquidáceas, bromeliáceas e aráceas, formação de dossel em áreas mais planas com indivíduos emergentes (altura acima de 15 m), mediana de DAP entre 15 e 30 cm. Foram observadas áreas com vegetação em estágio sucessional avançado apresentando indivíduos com alturas superiores a 18 m e DAP superiores a 50 cm.
Dentre as espécies mais representativas do estágio secundário médio/avançado de regeneração da Floresta Ombrófila Densa, como consta na Tabela 4, é possível citar: Guatteriahillariana, Rollinia sericea,Dendropanax cuneatum, Schefflera angustifólia, Astrocaryum aculleatissimum,Cordia ecalyculata,Calophyllum brasiliense,Dickysonia sellowiana,Abarema brachystachya,Dahlstedtia pentaphylla,Dalbergia frutescens, Hymenaea courbaril, Inga laurina, Inga sellowiana, Machaerium aculeatum, Heliconia velloziana, Nectandra oppositifolia, Ocotea pulchella, Miconia latecrenata, Cabralea canjerana, Guarea guidonia, Guarea macrophylla, Inga edulis, Mollinedia schottiana, Mollinedia ulleana, Siparuna brasiliensis, Coussapoa microcarpa, Ficus insipida, Ficus organensis, Virola bicuhyba, Campomanesia guaviroba, Eugenia brasiliensis, Eugenia leitonii, Eugenia ligustrina, Eugenia sulcata, Myrcia multiflora, Myrcia pubipetala,Syzygium cumini, Bathysa australis, Posoqueria latifólia, Psychotria cartagenensis, Psychotria leiocarpa, Psychotria nuda, Allophyllus edulis, Matayba elaeagnoides, Matayba junglandifolia, Chrysophyllum flexuosum, Ecclinusa ramifloraeManilkara subsericea.
Entre as espécies características de estágio inicial de regeneração dessa formação estão: Schinus terebintifolius, Tapirira guianensis, Allamanda catartica, Ilex theezans, Dypsis lutescens, Syagrus romanzoffiana, Asclepias curassavica, Baccharis trimera, Cecropia glaziovii, Cecropia pachystachya, Garcinia gardneriana, Terminalia catappa, Cyathea atrovirens, Alchornea sidifolia, Alchornea triplinervea, Croton floribundus, Hyeronima alchorneoides, Pera glabrata, Andira fraxinifolia, Piptadenia gonoacantha, Schizolobium parahyba, Casearia sylvestris, Gleichenella pectinata, Miconia cabussu, Miconia cinnamomifolia, Miconia cubatanensis, Miconia latecrenata, Tibouchina mutabilis, Tibouchina pulchra, Cissampelos andromorpha, Morus nigra, Rapanea ferrugínea, Rapanea umbellata, Myrcia fallax, Psidium guajava, Guapira opposita, Piper aduncum, Piper arboreum, Piper cernuum, Amaioua intermedia, Cupania oblongifolia, Cupania vernalis, Solanum pseudoquina, Luehea grandiflora, Trema micranta, Boehmeria caudata, Urera bacífera, Cytharexylum myrianthum, Vitex polygama e Aegiphila sellowiana (Tabela 4). Neste estágio sucessional não há formação de dossel devido ao porte menor dos indivíduos arbóreos (DAP ≤ 20 cm e alturas em torno de 6 a 8 m) e da distância entre os mesmos, possibilitando a penetração de luminosidade até o estrato herbáceo. Este último, mais diversificado e mais denso com menor quantidade de epífitas e maior quantidade de trepadeiras.
Próximas às áreas de residências e às margens da estrada foi observado o efeito de borda na formação florestal com espécies características de áreas perturbadas como bambuzais, trepadeiras e espécies de melastomatáceas (Figuras 11 e 12).
O manguezal, praticamente restrito à porção marginal ao Canal de Bertioga, se desenvolve em áreas estreitas (Figuras 12, 13 e 14) que estão bastante ocupadas por marinas, náuticas, heliporto e estacionamentos. Nesse ecossistema foram encontrados indivíduos adultos de Rizophoramangle, Avicenniaschaueriana, Lagunculariaracemosa e hibiscos.
A Vegetação Rupestre de Costão Rochoso registrada na área se apresenta composta basicamente por bromeliáceas e cactáceas, com poucos exemplares arbustivos como a “orelha de onça”. Foi observada por todo o Costão Rochoso próximo às áreas de praias, onde os borrifos da maresia são constantes (figura 15 a 17). Foram observados também alguns indivíduos de agaves (figura 18).
A Floresta Ombrófila de Terras Baixas foi amostrada em fragmento de vegetação mais conservado em área próxima a estrada após o Perequê. Considerando a proximidade do fragmento às áreas analisadas, infere-se que a vegetação tenha sido a mesma formando um continuo até a região da praia do Perequê. Esse fragmento apresenta um efeito de borda acentuado, com pressões por invasão e degradação de solo, indicando um estágio médio degradado de regeneração da Floresta em função da presença de remanescentes de espécies de grande porte (DAP≥ 30 cm e alturas de até 15 m).
Já os loteamentos de alto padrão, como os do Iporanga, São Pedro, Taguaíba e Tijucopava, estão impressos em áreas de vegetação florestal bem preservada nos terrenos da planície costeira - Floresta Ombrófila de Terras Baixas (Figuras 19 e 20) e naqueles bastante declivosos (declives de aproximadamente 45º). Aparentemente possuem planos de manejo da vegetação conservada e a ser preservada em função de TAC – Termo de Ajustamento de Conduta assumidos, com programas de recuperação de áreas degradadas e de educação ambiental, nos lotes e em áreas determinadas do Loteamento (informação dada). Possuem também a competência para o controle do acesso à área da praia pela imposição de restrições como a proibição de acesso a veículos de transporte coletivo e controle do número máximo de visitantes.
O Bairro do Perequê é um bairro de residências de média e baixa renda, com comércio estabelecido, onde podem ser observados problemas de saneamento básico em área de vegetação da planície costeira onde provavelmente se encontrava a maior parte da vegetação de Floresta Ombrófila de Terras Baixas, escrube e vegetação de dunas.
Já na Rodovia SP-61, observou-se um pequeno fragmento de Floresta Paludosa de Restinga próximo ao corte de vegetação para acesso à Linha de Transmissão de Energia Elétrica. Essa fitofisionomia se distingue da Floresta de Restinga pelo seu desenvolvimento em áreas alagadas com corpo de água de baixa velocidade encontradas entremeadas aos cordões arenosos da área da Planície Costeira. Desenvolvem-se nesses locais espécies tolerantes ao alagamento constante.
Outro local onde deveria se desenvolver a Floresta Ombrófila de Terras Baixas (Floresta Alta e Baixa de Restinga) é a região onde se encontra a comunidade da Prainha Branca (Figura 14). Com alguns vestígios da antiga formação florestal, pode-se observar pequenos fragmentos de escrube e vegetação de dunas, assim como vegetação herbácea de área alagada e provável manguezal (Figura 15).
No escrube foram amostrados Schinus terebintifolius, Clusia criuva, Davilla rugosa, Pera glabrata, Dalbergia ecastaphyllum, Gleichenella pectinata, Tibouchina holosericea, Myrcia pubipetala, Imperata brasiliense, Micrograma vaccinifilolia, Pteridium arachnoideum e Smilax rufescens (Figuras 16 a 19).
Foi constatada apenas uma área de reflorestamento com eucaliptos no topo do morro de São João próximo a comunidade da Prainha Branca (Figura 20), visível a partir do final do Canal de Bertioga, na região da balsa.
Áreas de clareiras (áreas de campo e/ou estágio pioneiro de regeneração) foram avistadas da praia e da estrada onde aparentemente estão sendo realizados desmatamentos irregulares da vegetação florestal de encosta com extração de madeira e abertura para provável cultivo de subsistência ou para estabelecimento de moradias (Figuras 21 e 22).
Nas áreas residenciais a proporção de espécies exóticas é significativa, tanto próxima às residências de alto padrão como naquelas mais simples.
Entre as espécies observadas no campo, o palmito e o xaxim se destacam por estarem ameaçadas de extinção (Tabela 3). O xaxim (Dicksonia sellowiana) encontra-se na categoria vulnerável, é uma espécie arborescente da qual se extrai o xaxim verdadeiro. Sua exploração é proibida no município e estado de São Paulo (Lei n0 13.442, de 14 de outubro de 2002 e Lei n0 11.754, de 1 de julho de 2004, respectivamente). Ocorre no sub-bosque de formações primárias e secundárias.
O palmito jussara (Euterpe edulis) pode atingir até 20m de altura. Diferencia-se de outras palmeiras pelas raízes visíveis na base do tronco e frutos arredondados, negros ou violáceos durante a maturação. Trata-se de uma espécie perenifólia, esciófita. Ocorre nas florestas primárias, floresta paludosa sobre substrato turfoso primária e floresta de transição primária. As normas para sua exploração de modo sustentável, no Estado de São Paulo, encontram-se na Resolução SMA 16 - de 21-6-94. Vale mencionar que o Loteamento Iporanga vem realizando o plantio de palmito na Serra, através do lançamento de sementes via helicóptero, desde junho 2007 (Ambiental Consulting, 2008).
A massaranduba (Manilkara subsericea), a brejaúva (Astrocaryum aculeatissimum) e o Chrysophyllum flexuosum foram mencionados na listagem da IUCN, porém com baixo risco de ameaça.
Tabela 4. Espécies observadas nas fitofisionomias da Serra do Guararu. Ambientes de ocorrência: Floresta Ombrófila Densa nos estágios Pioneiro (P), inicial (I) Médio-Avançado (A); Manguezal (M); Vegetação rupestre (V), vegetação de praia e dunas (D), escrube (E), vegetação sobre restinga (R). Serra do Guararu, Guarujá/SP. 22 a 24 de outubro de 2011.
| Nome científico | Família | Nome popular | Ambientes | |||||||
| M | R | P | I | A | V | D | E | |||
| Avicennia schauerianaStapf & Leechm. ex Moldenke | Acanthaceae | Siriúba | X | |||||||
| Mangifera indicaL. | Anacardiaceae | Mangueira | X | X | ||||||
| Schinus terebinthifoliusRaddi | Anacardiaceae | Aroeira vermelha | X | X | X | X | X | X | X | |
| Tapirira guianensisAubl. | Anacardiaceae | Peito de pomba | X | X | X | X | ||||
| Annona neosericea (sin.: Rollinia sericea)H.Rainer | Annonaceae | cortiça, araticum | X | |||||||
| Guatteria australis A.St.-Hil. | Annonaceae | Pindaúva | X | |||||||
| Allamanda catártica L. | Apocynaceae | dedal de rainha | X | X | ||||||
| Asclepias curassavicaL. | Apocynaceae | oficial de sala | X | X | ||||||
| Dendropanax cuneatus (DC.) Decne. & Planch. | Araliaceae | maria mole | X | |||||||
| Scheffleraangustissima (Sin.: Didymopanax angustissimum) (Marchal) Frodin | Araliaceae | rameira | X | |||||||
| Hydrocotyle bonariensisLam. | Araliaceae (Apiaceae) | erva capitão | X | |||||||
| Astrocaryum aculeatissimum (Schott) Burret | Arecaceae | Brejaúva | X | |||||||
| Bactris setosaMart. | Arecaceae | Tucum | X | X | ||||||
| Dypsis lutescens ( H.Wendl. ) Beentje & J.Dransf. | Arecaceae | Areca bambu | X | X | ||||||
| Euterpe edulisMart. | Arecaceae | Jussara | X | X | ||||||
| Geonoma elegansMart. | Arecaceae | aricanguinha | X | X | ||||||
| Syagrus romanzoffiana (Cham.) Glassman | Arecaceae | Gerivá | X | X | ||||||
| Baccharis crispa (sin. B. trimera)Spreng. | Asteraceae | carqueja | X | X | X | |||||
| Jacaranda puberulaCham. | Bignoniaceae | Carobinha | X | X | ||||||
| Cordia ecalyculataVell. | Boraginaceae | cha de bugre | X | |||||||
| Aechmea nudicaulis (L.) Griseb. | Bromeliaceae | gravatá | X | X | ||||||
| Bromelia antiacanthaBertol. | Bromeliaceae | Caraguatá | X | X | ||||||
| Cereus hildmannianus (sin. C. peruvianus)K.Schum. | Cactaceae | mandacaru | X | X | ||||||
| Opuntia monoacanthaHaw. | Cactaceae | palmatória | ||||||||
| Trema micranta (L.) Blume | Cannabaceae (Ulmaceae) | Candiúva | X | X | X | |||||
| Calophyllum brasilienseCambess. | Clusiaceae | Guanandi | X | |||||||
| Clusia criuvaCambess. | Clusiaceae | mangue do mato | X | X | ||||||
| Laguncularia racemosa (L.) C.F.Gaertn. | Combretaceae | Mangue-branco | X | |||||||
| Terminalia catappaL. | Combretaceae | Chapéu de sol | X | X | X | X | X | |||
| Ipomoea imperati (= I. litoralis) (Vahl). Griseb. | Convolvulaceae | salsa-da-praia | X | X | ||||||
| Ipomoea pres-caprae (L.) R.Br. | Convolvulaceae | campainha | X | |||||||
| Cyathea atrovirens (Langsd. & Fisch.) Domin | Cyatheaceae | Samambaiaçú | X | X | X | |||||
| Pteridium arachnoideum (Kaulf.) Maxon | Dennstaedtiaceae | samambaia das taperas | X | X | X | X | ||||
| Dicksonia sellowianaHook. | Dicksoniaceae | xaxim | X | |||||||
| Alchornea sidifoliaMüll.Arg. | Euphorbiaceae | Tapiá | X | X | ||||||
| Alchornea triplinervia(Spreng.) Müll.Arg. | Euphorbiaceae | Tapiá | X | X | X | |||||
| Croton floribundusSpreng. | Euphorbiaceae | capixingui, tapixingui | X | X | X | |||||
| Abarema brachystachya(DC.) Barneby & J.W.Grimes | Fabaceae | Olho de cabra azul | X | |||||||
| Andira fraxinifoliaBenth. | Fabaceae | Jacarandá do Mato | X | X | ||||||
| Dahlstedtia pentaphylla(Taub.) Burkart | Fabaceae | falsa eritrina | X | |||||||
| Dalbergia ecastaphyllum(L.) Taub. | Fabaceae | marmeleiro da praia | X | X | X | |||||
| Dalbergia frutescens(Vell.) Britton | Fabaceae | cipó preto | X | |||||||
| Hymenaea courbarilL. | Fabaceae | Jatobá | X | |||||||
| Inga edulisMart. | Fabaceae | Ingá | X | |||||||
| Inga laurina(Sw.) Willd. | Fabaceae | ingá branco | X | |||||||
| Machaerium aculeatumRaddi | Fabaceae | Jacarandá de espinho |
|
|
|
| X |
|
|
|
| Piptadenia gonoacantha(Mart.) J.F.Macbr. | Fabaceae | Pau jacaré | X | X | X | |||||
| Schizolobium parahyba(Vell.) Blake | Fabaceae | Guapuruvú | X | X | X | |||||
| Swartzia langsdorffiiRaddi | Fabaceae | pacová de macaco | ||||||||
| Gleichenella pectinata(Willd.) Ching | Gleicheniaceae | samambaia do barranco | X | X | X | |||||
| Heliconia vellozianaEmygdio | Heliconiaceae | helicônia, caetê | X | |||||||
| Aegiphila integrifolia (sin. A. sellowiana)(Jacq.) Moldenke | Lamiaceae (Verbenaceae) | Tamanqueira | X | X | X | |||||
| Vitex polygamaCham. | Lamiaceae (Verbenaceae) | tarumã | X | X | ||||||
| Nectandra oppositifoliaNees | Lauraceae | Canela-amarela | X | |||||||
| Ocotea pulchella (Nees & Mart.) Mez | Lauraceae | Canela do brejo | X | |||||||
| Lycopodiella alopecuroides(L.) Cranfill | Lycopodiaceae | licopódio | X | X | ||||||
| Lycopodiella cernua (L.) Pic.Serm. | Lycopodiaceae | licopódio | X | X | ||||||
| Talipariti pernambucense(Arruda) Bovini | Malvaceae | Hibisco | X | X | ||||||
| Luehea grandifloraMart. & Zucc. | Malvaceae (Tiliaceae) | Açoita cavalo | X | X | X | X | ||||
| Miconia cabucuHoehne | Melastomataceae | pixirica, pixiricão | X | X | ||||||
| Miconia cinnamomifolia(DC.) Naudin | Melastomataceae | jacatirão | X | X | ||||||
| Miconia cubatanensisHoehne | Melastomataceae | Jacatirão | X | X | ||||||
| Miconia latecrenata(DC.) Naudin | Melastomataceae | jacatirão | X | |||||||
| Tibouchina clavata (sin. T. holosericea)(Pers.) Wurdack | Melastomataceae | Orelha de onça |
| X |
|
|
|
| X | X |
| Tibouchina mutabilis(Vell.) Cogn. | Melastomataceae | Manacá da Serra | X | X | X | |||||
| Tibouchina pulchraCogn. | Melastomataceae | Manacá da Serra | X | X | X | |||||
| Cabralea canjerana(Vell.) Mart. | Meliaceae | Canjerana | X | |||||||
| Guarea guidonia(L.) Sleumer | Meliaceae | Marinheiro | X | |||||||
| Guarea macrophyllaVahl | Meliaceae | Marinheiro | X | |||||||
| Cissampelos andromorphaDC. | Menispermaceae | sem informação | X | X | X | |||||
| Mollinedia schottiana(Spreng.) Perkins | Monimiaceae | espinheira santa | X | |||||||
| Mollinedia uleanaPerkins | Monimiaceae | Pimenteira | X | |||||||
| Ficus insipidaWilld. | Moraceae | figueira | X | |||||||
| Ficus organensis(Miq.) Miq. | Moraceae | figueira | X | |||||||
| Morus nigraL. | Moraceae | Amoreira | X | X | ||||||
| Musa paradisíaca L. | Musaceae | Bananeira | X | X | X | |||||
| Virola bicuhyba(Schott ex Spreng.) Warb. | Myristicaceae | bicuíba | X | |||||||
| Myrsine coriacea (sin. Rapanea ferruginea)(Sw.) R.Br. ex Roem. & Schult. | Myrsinaceae | Capororoca |
| X | X | X | X |
|
|
|
| Rapanea umbellata(Mart.) Mez | Myrsinaceae | capororoca | X | X | X | X | ||||
| Calyptranthes lanceolataO.Berg | Myrtaceae | SI | X | |||||||
| Campomanesia guaviroba(DC.) Kiaersk. | Myrtaceae | guabiroba | X | |||||||
| Eugenia brasiliensisLam. | Myrtaceae | grumixama | X | |||||||
| Eugenia leitoniiLegr. | Myrtaceae | araçá piranga | X | |||||||
| Eugenia ligustrina(Sw.) Willd. | Myrtaceae | murta | X | |||||||
| Eugenia sulcataSpring ex Mart. | Myrtaceae | murta | X | |||||||
| Myrcia fallax(Rich.) DC. | Myrtaceae | murta | X | X | X | X | ||||
| Myrcia multiflora(Lam.) DC. | Myrtaceae | murta | X | |||||||
| Myrcia pubipetalaMiq. | Myrtaceae | murta | X | X | ||||||
| Psidium cattleyanumSabine | Myrtaceae | goiabeira | X | X | ||||||
| Psidium guajavaL. | Myrtaceae | Goiabeira | X | X | X | X | ||||
| Syzygium cumini(L.) Skeels | Myrtaceae | Jambolão | X | |||||||
| Guapira opposita(Vell.) Reitz | Nyctaginaceae | Maria Mole | X | X | X | |||||
| Pera glabrata(Schott) Poepp. ex Baill. | Peraceae | tabocuva | X | X | X | |||||
| Hieronyma alchorneoidesAllemão | Phyllanthaceae | licurana | X | X | ||||||
| Piper aduncumL. | Piperaceae | Tapa buraco | X | X | ||||||
| Piper arboreumAubl. | Piperaceae | Pariparoba | X | X | ||||||
| Piper cernuumVell. | Piperaceae | SI | X | X | ||||||
| Imperata brasilienseTrin. | Poaceae | capim sapé | X | X | ||||||
| Spartina ciliataBrongn. | Poaceae | capim salgado | X | |||||||
| Microgramma vacciniifilolia(Langsd. & Fisch.) Copel. | Polypodiaceae | sem informação | X | |||||||
| Rhizophora mangleL. | Rhizophoraceae | Manguevermelho | X | |||||||
| Amaioua intermediaMart. ex Schult. & Schult.f. | Rubiaceae | Marmelada | X | X | ||||||
| Bathysa australis (A.St.-Hil.) K.Schum. | Rubiaceae | sem informação | X | |||||||
| Posoqueria latifólia (Rudge) Schult. | Rubiaceae | Baga de macaco | X | |||||||
| Psychotria carthagenensisJacq. | Rubiaceae | chacrona, rainha | X | |||||||
| Psychotria leiocarpaCham. & Schltdl. | Rubiaceae | sem informação | X | |||||||
| Psychotria nuda(Cham. & Schltdl.) Wawra | Rubiaceae | SI | X | |||||||
| Casearia sylvestrisSw. | Salicaceae | Guaçatonga |
|
| X | X | X |
|
|
|
| Allophylus edulis(A.St.-Hil. et al.) Hieron. ex Niederl. | Sapindaceae | fruta de paraó, vacum | X | |||||||
| Cupania oblongifoliaMart. | Sapindaceae | Cuvatã | X | X | X | |||||
| Cupania vernalisCambess. | Sapindaceae | Cuvatã | X | X | ||||||
| Matayba elaeagnoidesRadlk. | Sapindaceae | mataiba, miguel pintado | X | |||||||
| Matayba junglandifolia(Cambess.) Radlk. | Sapindaceae | Camboatã | X | |||||||
| Chrysophyllum flexuosumMart. | Sapotaceae | sem informação | X | |||||||
| Ecclinusa ramifloraMart. | Sapotaceae | Abiu folha peluda | X | |||||||
| Manilkara subsericea(Mart.) Dubard | Sapotaceae | Massaranduba | X | |||||||
| Siparuna brasiliensis(Spreng.) A.DC. | Siparunaceae | limoeiro bravo | X | X | X | |||||
| Solanum pseudoquinaA.St.-Hil. | Solanaceae | joá | X | X | X | X | ||||
| Boehmeria caudataSw. | Urticaceae | Urtiga mansa | X | X | X | X | ||||
| Urera bacífera (L.) Gaudich. ex Wedd. | Urticaceae | Urtiga | X | X | X | |||||
| Cecropia glazioviiSnethl. | Urticaceae | Embaúba vermelha |
|
| X | X | X |
|
|
|
| Cecropia pachystachyaTrécul | Urticaceae | embaúba |
| X | X | X | X |
|
|
|
| Coussapoa microcarpa(Schott) Rizzini | Urticaceae (Moraceae) | mata pau | X | |||||||
| CitharexylummyrianthumCham. | Verbenaceae | Pau-tucano | X | X | X | |||||
Tabela 5. Espécies observadas nas fitofisionomias da Serra do Guararu. Ameaçadas de Extinção, listagem estadual (SP), nacional (BR) e internacional (IUCN); N: Não, S: Sim, S/I: Sem Informação; categorias, VU: vulnerável, EP: em perigo, NA: não ameaçada, DI: dados insuficientes; BR: baixo risco. Bioindicadores – Floresta Ombrófila Densa nos estágios pioneiro (P), inicial (EI), médio (EM), avançado (EA); EP: escrube, vegetação primária; EA: escrube em estágio avançado; RBP: restinga baixa, vegetação primária; RBI: restinga baixa em estágio inicial; RBA: restinga baixa em estágio avançado; RAP: restinga alta, vegetação primária; RAI: restinga alta em estágio inicial; RAM: restinga alta em estágio médio; FP: floresta paludosa; FPI: floresta paludosa em estágio inicial; FPM: floresta paludosa em estágio médio; FPA: floresta paludosa em estágio avançado. FTP: floresta de transição restinga-encosta primária FTM: floresta de transição restinga-encosta em estágio médio; RPD: restinga de praias e dunas.
| Nome científico | Família | Interesse medicinal e econômico | Endêmica do Brasil | Ameaça | Bioindi- | ||
| SP | BR | IUCN | |||||
| Avicennia schaueriana | Acanthaceae | Restauração da vegetação | não | N | N | NA | Não |
| Mangifera indica | Anacardiaceae | Alimentação | não | N | N | DI | Não |
| Schinus terebinthifolius | Anacardiaceae | Restauração da vegetação | não | N | N | N | P, EP |
| Tapirira guianensis | Anacardiaceae | Paisagismo, restau-ração, uso da madeira | não | N | N | N | EM |
| Annona neosericea (sin.: Rollinia sericea) | Annonaceae | Uso da madeira, paisagismo, restauração | sim | N | N | N | Não |
| Guatteria australis | Annonaceae | Restauração da vegetação | sim | N | N | N | Não |
| Allamanda cathartica | Apocynaceae | Paisagismo | não | N | N | N | Não |
| Asclepias curassavica | Apocynaceae | Planta tóxica | não | N | N | N | Não |
| Dendropanax cuneatus | Araliaceae | Uso da madeira, paisagismo, restauração | não | N | N | N | Não |
| Scheffleraangustissima (Sin.: Didymopanax angustissimum) | Araliaceae | Restauração da vegetação | sim | N | N | N | EM/FTP |
| Hydrocotyle bonariensis | Araliaceae (Apiaceae) | Sem informação | não | N | N | N | RPD |
| Astrocaryum aculeatissimum | Arecaceae | Uso da madeira, paisagismo, medicinal | sim | N | N | BR | RBP |
| Bactris setosa | Arecaceae | Paisagismo | sim | N | N | N | RBP, FP, FT |
| Dypsis lutescens | Arecaceae | Paisagismo | não | N | N | N | Não |
| Euterpe edulis | Arecaceae | Alimentação, restauração da vegetação | não | VU | S | N | EM, RAP, FT |
| Geonoma elegans | Arecaceae | Paisagismo | sim | N | N | N | RBA |
| Syagrus romanzoffiana | Arecaceae | Paisagismo | não | N | N | N | RBP |
| Baccharis crispa (sin. B. trimera) | Asteraceae | Medicinal | não | N | N | N | P, EM, RBI |
| Jacaranda puberula | Bignoniaceae | Uso da madeira, paisagismo, restauração | sim | N | N | N | Não |
| Cordia ecalyculata | Boraginaceae | Uso da madeira, paisagismo, restauração | não | N | N | N | Não |
| Aechmea nudicaulis | Bromeliaceae | Paisagismo | não | N | N | N | EP |
| Bromelia antiacantha | Bromeliaceae | Paisagismo, medicinal | não | N | N | N | Não |
| Cereus hildmannianus (sin. C. peruvianus) | Cactaceae | Paisagismo | não | N | N | N | RPD |
| Opuntia monoacantha | Cactaceae | Paisagismo | não | N | N | NA | RPD |
| Trema micrantha | Cannabaceae (Ulmaceae) | Uso da madeira, restauração, melífera | não | N | N | N | P |
| Calophyllum brasiliense | Clusiaceae | Uso da madeira, paisagismo, restauração | não | N | N | N | EA, RAP, FP |
| Clusia criuva | Clusiaceae | Paisagismo, restauração da vegetação | sim | N | N | N | RBP/RBI/RBA/RAP/RAM |
| Laguncularia racemosa | Combretaceae | Restauração da vegetação | não | N | N | NA | Não |
| Terminalia catappa | Combretaceae | Paisagismo | não | N | N | N | Não |
| Ipomoea imperati (= I. litoralis) | Convolvulaceae | Paisagismo | não | N | N | N | RPD |
| Ipomoea pres-caprae | Convolvulaceae | Paisagismo | não | N | N | N | RPD |
| Cyathea atrovirens | Cyatheaceae | Restauração da vegetação | sim | N | N | N | RAP, FP, FT |
| Pteridium arachnoideum | Dennstaedtiaceae | Planta daninha | não | N | N | N | P |
| Dicksonia sellowiana | Dicksoniaceae | Paisagismo | não | VU | S | N | Não |
| Alchornea sidifolia | Euphorbiaceae | Restauração da vegetação | não | N | N | N | P, FTI |
| Alchornea triplinervia | Euphorbiaceae | Uso da madeira, restauração | não | N | N | N | FTI |
| Croton floribundus | Euphorbiaceae | Uso da madeira, melífera, restauração | sim | N | N | N | Não |
| Abarema brachystachya | Fabaceae | Restauração da vegetação | não | N | N | N | EP |
| Andira fraxinifolia | Fabaceae | Uso da madeira, paisagismo, restauração | sim | N | N | N | EM, FTI |
| Dahlstedtia pentaphylla | Fabaceae | Restauração da vegetação | sim | N | N | N | Não |
| Dalbergia ecastaphyllum | Fabaceae | Sem informação | não | N | N | N | EA/EP/EEA |
|
|
|
|
|
|
|
|
|
| Nome científico | Família | Interesse medicinal e econômico | Endêmica do Brasil | Ameaça | Bioindi- | ||
| SP | BR | IUCN | |||||
| Dalbergia frutescens | Fabaceae | Restauração da vegetação | não | N | N | N | EA |
| Hymenaea courbaril | Fabaceae | Uso da madeira, restauração, alimentação | nãol | N | N | N | EA |
| Inga edulis | Fabaceae | Uso da madeira, alimentação | não | N | N | N | Não |
| Inga laurina | Fabaceae | Uso da madeira | não | N | N | N | Não |
| achaerium aculeatum | Fabaceae | Uso da madeira, paisagismo, restauração | sim | N | N | N | EM |
| Piptadenia gonoacantha | Fabaceae | Uso da madera, restauração, melífera | não | N | N | N | Não |
| Schizolobium parahyba | Fabaceae | Uso da medeira, restauração | não | N | N | N | EM |
| Swartzia langsdorffii | Fabaceae | Uso da madeira, paisagismo, restauração | sim | N | N | N | Não |
| Gleichenella pectinata | Gleicheniaceae | Planta daninha | não | N | N | N | Não |
| Heliconia velloziana | Heliconiaceae | Paisagismo | - | N | N | N | Não |
| Aegiphila integrifolia (sin. A. sellowiana) | Lamiaceae (Verbenaceae) | Uso da madeira, restauração, melífera | não | N | N | N | Não |
| Vitex polygama | Lamiaceae (Verbenaceae) | Restauração da vegetação | sim | N | N | N | Não |
| Nectandra oppositifolia | Lauraceae | Uso da madeira, paisagismo | não | N | N | N | EM |
| Ocotea pulchella | Lauraceae | Uso da madeira, paisagismo, restauração | não | N | N | N | EM, EP, RAP, RAM |
| Lycopodiella alopecuroides | Lycopodiaceae | Sem informação | não | N | N | N | Não |
| Lycopodiella cernua | Lycopodiaceae | Sem informação | não | N | N | N | Não |
| Talipariti pernambucense | Malvaceae | Uso da madeira, paisagismo, restauração | não | N | N | N | Não |
| Luehea grandiflora | Malvaceae (Tiliaceae) | Uso da madeira, paisagismo, restauração | não | N | N | N | EM |
| Miconia cabucu | Melastomataceae | Uso da madeira, restauração da vegetação | sim | N | N | N | EA/EI |
| Miconia cinnamomifolia | Melastomataceae | Restauração da vegetação | sim | N | N | N | EA/EI |
| Miconia cubatanensis | Melastomataceae | Sem informação | sim | N | N | N | P |
| Miconia latecrenata | Melastomataceae | Sem informação | sim | N | N | N | P |
4.2.1.5. Discussão e Conclusão
Nos estudos realizados para a elaboração de Diretrizes para a Conservação e Restauração da Biodiversidade no Estado de São Paulo, a Serra do Guararu representa uma área com 25 a 50% de indicação para a criação de uma Unidade de Conservação (UC) de Proteção Integral, uma vez que possui grande remanescente de vegetação natural conservada. Quando comparada com outras formações vegetais, a Floresta Ombrófila Densa de Encosta é considerada a formação mais representativa em termos de área na Serra do Guararu e a mais preservada, o que evidencia a importância de sua proteção.
A Serra do Guararu obteve 3 (três) indicações relativas aos grupos de mamíferos, aves e fanerógamas, para o estabelecimento de ações que visem o incremento de conectividade entre áreas preservadas. Essas ações podem se dar tanto pelo aumento de UCs já implantadas, como no caso da indicação para o grupo dos mamíferos, como pela restauração florestal e criação de reserva particular de patrimônio natural (RPPN), como no caso das aves, ou, ainda, pela implementação de uma UC de proteção integral, como para as fanerógamas.
Esses três indicadores são reconhecidamente aqueles que possuem mais estudos e diagnósticos de áreas, usados para a determinação dos estágios de conservação ou regeneração destes ecossistemas, como se pode observar através da legislação ambiental vigente. São, consequentemente, elementos chave para auxiliar nas tomadas de decisão na gestão dessas áreas. Este fato evidencia a indicação da Serra do Guararu como uma área de interesse eminente para a implantação de uma política pública que efetive a conservação de sua natureza no contexto de todo o Estado de São Paulo.
As Florestas Ombrófilas de Terras Baixas foram praticamente extintas nessa região (Serra do Guararu), principalmente pela ocupação residencial dos moradores do Bairro do Perequê, da Prainha Branca e dos loteamentos de alto padrão como do Iporanga e São Pedro. De forma semelhante, a vegetação dos manguezais foi em parte destruída pela instalação de marinas, náuticas e estacionamentos junto ao canal de Bertioga. Existem, também, pequenas manchas de vegetação rupestre dos costões rochosos da vertente da Serra voltada para o oceano, onde estão implantados os loteamentos de alto padrão.
Como já apresentado, os maiores remanescentes vegetais da região são de Floresta Ombrófila Densa de Encosta, presentes nas áreas ainda não perturbadas pela expansão de casas e dos loteamentos. Como visto em observações de campo, a vegetação, principalmente fanerogâmica, ainda resiste em manter o estágio de regeneração sucessional médio a avançado como situação predominante, o que corrobora a indicação dada no estudo mencionado anteriormente.
Apesar de esforços para a conservação da natureza com a implantação da Estrada-Parque da Serra do Guararu e do seu tombamento como área especialmente protegida pelo Estado, estão presentes nesta Serra loteamentos de alto a baixo padrão, condomínios com e sem programas de conservação da qualidade ambiental, exploração turística em expansão com atração de atividades comerciais e operação de marinas de capital privado, tanto em áreas proibidas de preservação permanente (encostas íngremes, margens de corpos de água e de criadouro de espécies aquáticas, por exemplo), como em áreas autorizadas por órgão ambiental competente com programas de compensação ambiental e medidas mitigatórias aplicadas.
É necessário salientar a existência de comunidades tradicionais ou aquelas anteriores à especulação imobiliária e portuária do local, que merecem atenção diferenciada com o que se refere ao acesso aos recursos naturais locais, uma vez que sua relação com o ambiente natural é maior, principalmente por ser mais antiga e mais diretamente dependente.
Apesar do número aparentemente razoável de áreas destinadas para a conservação da natureza, esforços mais contundentes são necessários nas medidas para a contenção da invasão e destruição crônica das áreas de restrição mais brandas. Áreas como a da Serra do Guararu são alvo de pressões crescentes da especulação imobiliária e do turismo desordenado, exatamente pela oferta de ambientes razoavelmente conservados, mas extremamente vulneráveis ao manejo destrutivo não orientado.
Vários são os argumentos que destacam a Serra do Guararu como uma área indicada para a implantação de uma Unidade de Conservação, no mínimo de Uso Sustentável, como a diversidade de fitofisionomias compreendidas na mesma região, o razoável grau de conservação e integridade da vegetação nativa, e a proximidade com UCs de proteção integral. Tudo isso, vale ressaltar, apesar da crescente fragmentação em função da expansão urbana não controlada e da ausência de efetivos corredores ecológicos entre as regiões conservadas.
4.2.2. Fauna
A fauna da Serra do Mar é muito diversificada e, por estar inserida na porção mais desenvolvida e ocupada do território brasileiro, relativamente bem conhecida. Para se ter uma idéia de sua diversidade, ela abriga 5 espécies de primatas, 75 espécies de serpentes, mais de 500 espécies de aves e entorno de 1.000 espécies de borboletas. Essas espécies não se distribuem de maneira homogênea pela região, e os padrões de distribuição, bem como a composição faunística da maioria das localidades específicas, não são claramente conhecidos.
A Serra do Guararu está inserida num dos únicos corredores de ligação contínua entre o oceano e a Serra do Mar, ainda pouco comprometidos pela urbanização, sendo uma das últimas porções de dimensões significativas de Floresta Atlântica em bom estado de conservação na planície costeira do litoral central do estado de São Paulo. Apesar da proximidade de alguns dos centros de pesquisa mais desenvolvidos do estado, inclusive aqueles localizados na capital, levantamentos e estudos faunísticos são muito escassos para a Serra do Guararu. Nesse sentido, a serra como um todo poderia ser considerada uma lacuna no que se refere ao conhecimento da fauna.
Os dados mais abrangentes sobre a referida serra provem de estudos de impacto ambiental e planos de manejo realizados em alguns loteamentos implantados na área (como o Iporanga), que apresentam listagens relativamente recentes e parcialmente completas de alguns grupos de vertebrados, mas consideraram apenas uma fração do território e não o maciço como um todo. Não obstante, esses dados mostram que a serra abriga uma fauna rica e diversificada comparável àquela registrada para as planícies e baixas encostas do litoral centro-sul do estado. Ademais, existe uma quantidade expressiva de trabalhos realizados no entorno imediato da Serra do Guararu, tanto em áreas serranas do continente, quanto na baixada adjacente à Ilha de Santo Amaro (Guarujá), que permitem fazer inferências sobre o local. Desse modo, a estratégia de caracterização da fauna adotada por esse trabalho consistiu em:
• num primeiro momento, determinar os padrões biogeográficos da fauna na região onde se insere a serra, bem como os fatores que o condicionam e as espécies de maior interesse conservacionista (endêmicas ou ameaçadas) com base no conhecimento científico sedimentado;
• posteriormente, discutir as particularidades da fauna local com base no que foi levantado na área e adjacências imediatas, apresentando uma lista comentada das espécies registradas até o momento.
voltar ao topo
4.2.2.1. Caracterização da Fauna da Região da Baixada Santista
• Padrões Zoogeográficos
O Complexo Florestal Atlântico engloba diversas formações florestais heterogêneas, que interagem de maneira intrincada em gradientes de altitude e latitude ao longo do litoral brasileiro. Além disso, restingas, jundus, florestas paludosas, manguezais e campos rupestres são fitofisionomias de distribuição mais restrita, que refletem a influência de fatores abióticos pontuais característicos, como o tipo de solo, a incidência de fogo, a disponibilidade hídrica, a influência marinha entre outros, e que também interagem com os biomas florestais dominantes.
Dentro do Complexo Florestal Atlântico, as florestas ombrófilas densas de encosta definem um conjunto fitofisionômico conspícuo, imediatamente associado à imagem mais típica e popular da chamada Mata Atlântica. Essas florestas estão associadas a fatores abióticos marcantes que condicionam a paisagem:
• No plano geológico, estão instaladas sobre falhamentos do Embasamento Cristalino onde as condições geomorfológicas predominantes são maciços serranos de relevo escarpado, com solos pouco profundos de baixa a média fertilidade, entre os quais se destaca a Serra do Mar. Na faixa costeira, há planícies estreitas formadas pela deposição de cordões arenosos e permeadas por complexos estuarinos associados à foz de rios de maior porte.
• No plano climático associam-se a áreas de características tropicais, mesmo em quando situadas em zona extratropical, por conta da influência oceânica. As temperaturas são amenas (médias acima de 15º C) e a pluviosidade é alta (mais de 1.800 mm/ano), sem um período seco definido. Nota-se ainda a ocorrência ocasional de geadas nos meses de inverno e início da primavera.
As florestas ombrófilas densas de encosta apresentam uma biota característica que justificou a delimitação de uma ecorregião própria, denominada Ecorregião Serra do Mar (em referência ao seu maciço serrano principal) dentro do complexo atlântico. Particularmente no que se refere à fauna, essas florestas mostram características próprias que justificam a delimitação de províncias faunísticas diferenciadas para determinados grupos animais, como por exemplo, a chamada província costeira definida para a mastofauna.
Os padrões de distribuição biogeográficos das florestas ombrófilas de encosta são bastante influenciados pelas condições acima citadas, e se caracterizam pela ocorrência restrita de diversas espécies da fauna e flora, grande incidência de endemismos e existência do gradiente vertical de distribuição das espécies ao longo das encostas e no sentido norte-sul. Tais padrões são importantes quando se considera a estratégia de conservação dessa biodiversidade, pelo que é feita uma descrição mais detalhada dos mesmos nos parágrafos subsequentes.
Algumas restrições na distribuição das espécies relacionam-se com condições ambientais especiais, ou a barreiras físicas difíceis de serem transpostas, que se repetem ao longo da região e diminuem ou impedem o fluxo gênico entre populações. No caso das áreas serranas, este fator é um dos principais geradores de diversidade e endemismos, uma vez que as condições abióticas das cadeias de morros e dos vales adjacentes são sempre muito distintas, se acentuam com as mudanças climáticas (naturais ou antrópicas), e dificultam a colonização e dispersão dos indivíduos. Tal fenômeno é exemplificado pelos anfíbios associados aos riachos de corredeira característicos das florestas de encosta atlânticas, onde cada espécie de um mesmo complexo, ligada a um maciço serrano ou bacia hidrográfica de maior porte é diferente. Outros exemplos são as inúmeras plantas rupícolas dos campos de altitude e o gênero Brachycephalus de sapos de serrapilheira, que costumam ter espécies irmãs isoladas em morros vizinhos.
No caso dos maciços menores e isolados existentes ao longo do litoral, como a Serra do Guararu (e também a Ilha do Cardoso, o Maciço da Juréia, a Ilha de São Sebastião, a Ilha Anchieta e a Ilha Grande, entre outras), a insularização criada pelas transgressões marinhas durante os últimos interglaciais acentuou o isolamento das populações de invertebrados e pequenos vertebrados terrestres. Desse modo, é possível que existam no local, linhagens divergentes e espécies crípticas ainda não descritas, como aquelas que vêm sendo descobertas em outros maciços citados (ex Hylodes dactylocinus e Scinax jureia no Maciço da Juréia, e Bothrops alcatraz e Scinax alcatraz na ilha de Alcatrazes). Porém, o atual estado de conhecimento dessa fauna como um todo só permite que se façam especulações mais generalizadas sobre esse tema.
Já o gradiente vertical encontrado entre as planícies litorâneas e as florestas ombrófilas de encosta é resultado de um fenômeno macrorregional, que produz variação gradual na biota de modo semelhante ao longo do litoral sul e sudeste do território brasileiro. A combinação de solos, relevo e microclima resulta na estratificação fitofisionômica com transições suaves, e ligeiras diferenças associadas a particularidades numa escala geográfica menor. Assim, é praticamente impossível determinar limites de ocorrência bem definidos para as espécies distribuídas no gradiente. No entanto, alguns fenômenos claros têm sido identificados no que se refere a fluxos de espécies ao longo do mesmo gradiente. Observou-se, por exemplo, que aves frugívoras de maior porte, como cotingídeos e psitacídeos, se distribuem preferencialmente entre serras e baixadas dentro de um padrão sazonal, que muito provavelmente está ligado à oferta de frutos em épocas distintas. Dado que os ciclos fenológicos das plantas e a própria composição florística muda ao longo do gradiente vertical é até intuitivo pensar que existam deslocamentos sistemáticos nas comunidades de animais frugívoros e nectarívoros ao longo do ano, e que esses deslocamentos tenham reflexos no fluxo de propágulos. Tais fenômenos reforçam a importância da preservação de corredores contínuos ao longo desses gradientes, que é precisamente o caso da Serra do Guararu. Do mesmo modo que existe o uso diferenciado das florestas no gradiente de altitude, observam-se interrelações nos padrões de distribuição de espécies entre os ambientes de floresta e mangue nas regiões estuarinas, e estes últimos tem se mostrado sítios de reprodução e alimentação importantes para algumas espécies associadas à floresta. Novamente se destaca a Serra do Guararu pela proximidade existente entre suas encostas e o estuário de Bertioga.
Outro fenômeno de variação macrorregional verificado nas florestas de encosta atlânticas é o gradiente resultante da mudança de latitudes. Como o litoral brasileiro está orientado na direção norte-sul e está contido nas zonas tropical e subtropical (temperada), forma-se mais um gradiente de distribuição de espécies, desta vez associado ao clima. O aumento da latitude faz baixar as temperaturas médias e crescer a incidência de geadas (prejudicando diversas espécies tropicais) e, como resultado, há a substituição gradual de espécies nas comunidades à medida que nos deslocamos na direção norte-sul (com diminuição da diversidade à medida que nos movemos para o sul). Também há uma interação acentuada entre latitude e altitude, o que torna ainda mais complexo o quadro de variações e, conforme se avança em direção ao sul, as formações de floresta ombrófila densa montana e altomontana passam a ocorrer em altitudes cada vez mais baixas. Na Mata Atlântica, um fenômeno de distribuição bastante característico associado à interação entre latitude e altitude afeta diversos pares de espécies irmãs (ex. Ramphastus dicolorus X R. v. ariel; Carpornis cucullata X C. melanocephala; Delomys dorsalis X D. sublineatus; e Marmosops paolensis X M. incanus). Em um determinado ponto do gradiente, espécies de um mesmo par costumam se segregar espacialmente, uma nas florestas montanas e altomontanas, mais frias, e outra nas florestas submontanas e de terras baixas, mais quentes. À medida que se avança em sentido sul, as espécies associadas ao clima mais frio tendem a ocorrer em altitudes cada vez menores, até substituírem a irmã mesmo na zona costeira; por outro lado, quando no sentido norte, observa-se o inverso, com a espécie associada ao clima mais quente ocorrendo em altitudes cada vez maiores. Porém, como essa segregação é tênue e apoiada em fatores abióticos com grande amplitude de variação sazonal e interanual, há localidades onde se observa simpatria, como nas serras mais baixas ao longo do litoral paulista (novamente onde se enquadra a Serra do Guararu), que resulta no aumento da biodiversidade local.
Como se observa pelas considerações acima, a Serra do Guararu possui atributos que amplificam sua relevância do ponto de vista zoogeográfico em quaisquer dos aspectos considerados.
• Espécies de Interesse Particular
O Bioma da Mata Atlântica é mundialmente reconhecido como um Hotspot de biodiversidade por conta do alto grau de endemismo e ameaça de sua biota. Porém, em função das características do complexo florestal atlântico e das próprias florestas ombrófilas de encosta, não há muitos endemismos ligados somente a esse tipo de formação florestal. As espécies endêmicas do bioma ou tem distribuição pontual e localizada, predominantemente associadas aos diferentes maciços serranos, encraves e ambientes fortemente condicionados por fatores abióticos, ou são associadas ao bioma como um todo (ou grande parte dele), ainda que o grosso da sua distribuição potencial se concentre num ou noutro tipo de floresta do complexo.
Um exemplo é a ornitofauna: a Mata Atlântica tem cerca de 200 espécies aves endêmicas, muitas das quais de distribuição ampla ao longo da costa brasileira, ocorrendo desde o sul do Estado da Bahia até o norte do Rio Grande do Sul, e seguindo pelo interior do Paraná até a região de Missiones, em território Argentino. Aproximadamente 10% (20 espécies) são endêmicas, ou preponderantemente distribuídas nas florestas de encosta da Serra do Mar, sendo algumas de ocorrência bastante restrita, mas cuja distribuição potencial não inclui a área de interesse (ex. Formicivora erythronotos, Formicivora littoralis, Phyloscartes kronei, etc).
A compilação mais recente sobre a fauna de vertebrados presente ou potencialmente presente na baixada santista foi feita durante o processo de criação de uma unidade de conservação no município de Bertioga (Fundação Florestal et all., 2008 - http://www.fflorestal.sp.gov.br/media/uploads/bertioga/VolumePrincipal/volumePrincipal.pdf), praticamente adjacente à Serra do Guararu (está separada da mesma por um complexo de manguezais na foz do rio Itapanhaú e pelo próprio canal do rio). Essa unidade abrange grande parte das florestas de planície litorânea remanescentes no município, ao longo da Bacia dos rios Itapanhaú e Guaratuba, e representa um passo fundamental para a criação de corredores extensos de ligação entre a zona costeira, a baixada litorânea e a encosta, integrando-se à própria área aqui estudada. No referido levantamento foram considerados a mastofauna, avifauna e herpetofauna (répteis e anfíbios), tendo sido relatados 117 espécies de mamíferos, 407 espécies de aves, 53 espécies de anfíbios e 40 espécies de répteis (sendo esses últimos dois grupos provavelmente subestimados, em função do elevado número de ocorrências históricas registradas em áreas adjacentes (Santos, Paranapiacaba e Estação Ecológica da Boracéia-MZUSP). Ressalta-se ainda o elevado número de taxa ameaçados presentes na lista.
Entre os endemismos cujas distribuições potenciais abrangem a área de interesse, aqueles que se destacam incluem uma série de gêneros de roedores – Delomys, Rhagomys, Phaenomys, Phyllomys, Nelomys, Kannabateomys –, alguns dos quais bastante raros, só recentemente redescobertos (final da década de 1990); o muriqui (Brachyteles arachnoides) e o sagüi-preto (Callithryx aurita), anfíbios associados a riachos de corredeira (gêneros Hylodes, Crossodacytus, Megaelosia, Cyclorramphus, Hyalinobatrachyum, Phasmahyla, e Phrynomedusa), rãs de serrapilheira da família Brachycephalidae, cágados do gênero Hydromedusa – H. maximiliani e H. tectifera – que ocorrem nos mesmos ambientes, o lagarto Placosoma glabelum (Gymnophtalmidae) associado às bromélias da floresta ombrófila densa submontana, o jacaré-de-papo-amarelo (Caiman latirostris), ameaçado de extinção, e algumas ocorrências históricas muito raras e até presumivelmente extintas da herpetofauna (Phrynomedusa fimbriata e Corallus cropani).
Entre as aves destacam-se três espécies de psitacídeos – sabiá-cica (Triclaria malachitae), apuim-de-costas-pretas (Touit melanonotus) e papagaio-moleiro (Amazona farinosa) -, os cotingídeos (Carpornis melnocephalus, Procnia nudicollis e Pyroderus scutatus), saíras (Nemosia rourei, Dacnis nigripes, Thraupis cyanoptera e Tangara desmaresti), o gavião-pombo-pequeno (Leucopternis lacernulatus), o tauató-pintado (Accipiter poliogaster), o jaó-do-sul (Crypturellus noctivagus) e a jacutinga (Aburria jacutinga) que, além de endêmicas, são estadual ou nacionalmente ameaçadas de extinção.
Além das espécies endêmicas a região conta com populações significativas de vertebrados de maior porte (antas, porcos-do-mato, veados e felinos médios e grandes) que sofrem com a pressão de caça e perda de habitats em outras partes do estado.
Entre os invertebrados há na região uma grande lacuna de conhecimento. A fauna de invertebrados associada às florestas tropicais costuma ser rica e desconhecida, e a Serra do Mar não foge à regra. O único grupo que conta com informações relativamente sistematizadas para a baixada santista é o de borboletas. Francini et all.(2011) listam 538 espécies de borboletas para a região da baixada santista (incluindo Itanhaém, São Vicente e Bertioga), que representam cerca de metade das espécies de borboletas conhecidas para a Ecorregião da Serra do Mar e um terço das espécies registradas no estado de São Paulo.
4.2.2.2. Fauna Presente e Potencialmente Presente na Serra do Guararu
Como mencionado anteriormente, os levantamentos faunísticos realizados na Serra do Guararu estão restritos a poucos grupos taxonômicos – inventários de aves, mamíferos e registros pontuais de répteis– e cobrem uma área limitada, ainda que bastante preservada do território.
A Tabela 6 abaixo compara a fauna de mamíferos terrestres registrada para a área lindeira (baseada nos levantamentos realizados para a criação do Parque Estadual da Restinga em Bertioga) e na área do Loteamento Iporanga, dentro da Serra do Guararu.
Tabela 6. Mamíferos Terrestres registrados no Município de Bertioga e na Serra do Guararu (Loteamento Iporanga).
| Nome Científico | Nome Popular | Resgistro no Guararu Lotemaneto Iporanga |
| Didelphis aurita | Gambá-de-orelha-preta | X |
| Gracilinanus microtarsus | Catita |
|
| Lutreolina crassicaudata | Cuíca-de-cauda-grossa |
|
| Marmosops incanus | Catita | X |
| Metachirus nudicaudatus | Jupati | X |
| Micoureus paraguayanus | Guaiquica-cinza. | X |
| Monodelphis americana | Cuíca-listrada |
|
| Monodelphis scalops | Catita |
|
| Philander frenatus | Cuíca-de-quatro-olhos-cinzenta | X |
| Akodon cursor | Camundongo-do-mato | X |
| Chironectes minimus | Cuíca-d’água | X |
| Euryoryzomys russatus | Rato-do-arroz |
|
| Juliomys pictipes | Rato-de-focinho-vermelho |
|
| Nectomys squamipes | Rato-d'água | X |
| Oecomys catherinae | Rato-de-árvore |
|
| Oligoryzomys flavescens | Camundongo-amarelo |
|
| Oligoryzomys nigripes | Camundongo-de-pé-preto |
|
| Rhipidomys mastacalis | Rato-de-árvore |
|
| Thaptomys nigrita | Camundongo-do-mato-preto |
|
| Phyllomys nigrispinus | Rato-de-espinho |
|
| Phyllomys thomasi | Rato-de-espinho |
|
| Trinomys iheringi | Rato-de-espinho-da-Mata-Atlântica | X |
| Kannabateomys amblyonyx | Rato-da-taquara | X |
| Sciurus ingrami | Caxinguelê | X |
| Cuniculus paca | Paca | X |
| Dasyprocta aff. Leporina | Cotia | X |
| Sphiggurus villosus | Ouriço-caxeiro | X |
| Hydrochoerus hydrochaeris | Capivara | X |
| Cavia aperea | Preá | X |
| Mazama gouazoubira | Veado-catingueiro | X |
| Mazama americana | Veado-mateiro | X |
| Pecari tajacu | Cateto |
|
| Tayassu pecari | Queixada |
|
| Cerdocyon thous | Cachorro-do-mato | X |
| Leopardus pardalis | Jaguatirica | X |
| Leopardus tigrinus | Gato-do-mato |
|
| Leopardus wiedii | Gato-maracajá | X |
| Puma concolor | Suçuarana | X |
| Eira barbara | Irara | X |
| Galictis cuja | Furão-pequeno | X |
| Lontra longicaudis | Lontra | X |
| Nasua nasua | Quati | X |
| Procyon cancrivorus | Mão-pelada | X |
| Sylvilagus brasiliensis | Tapiti | X |
| Tapirus terrestris | Anta |
|
| Alouatta guariba | Bugio | X |
| Brachyteles arachnoides | Mono-carvoeiro |
|
| Callithrix aurita | Saguí-de-tufo-preto |
|
| Cebus nigritus | Macaco-prego | X |
| Bradypus variegatus | Preguiça-de-garganta-marrom | X |
| Dasypus novemcinctus | Tatu-galinha | X |
| Cabassous unicinctus | Tatu-de-rabo-mole | X |
| Tamandua tetradactyla | Tamanduá-mirim | X |
*Espécies grafadas em vermelho foram registradas na área da Serra do Guararu, mas não são citadas nos levantamentos realizados em Bertioga.
Observa-se pela tabela que das 53 espécies com ocorrência registrada ou prevista para a referida região da baixada litorânea, 34 já foram observadas direta ou indiretamente no pequeno trecho amostrado na Serra do Guararu. Quatro espécies – Cerdocyon thous, Mazama americana, Chironectes minimus e Kannabateomys amblyonyx - foram registradas na serra e não constam dos levantamentos realizados em Bertioga. As duas primeiras têm distribuição ampla pelo país, enquanto as duas últimas são consideradas ameaçadas de extinção no estado. C. minimus é um marsupial que vive associado aos cursos d’água da floresta e tem distribuição ampla, mas pouco conhecida, enquanto K. amblyonyx é um rato-de-espinho endêmico da Mata Atlântica que vive associado a taquarais. Ressalta-se que suas distribuições potenciais incluem o município de Bertioga e é provável que lá ocorram, tanto na baixada, quanto nas cotas mais baixas da Serra do Mar. Duas espécies citadas no levantamento do Iporanga - Cabassous unicinctus e Cavia aperea – não tem registro para a baixada, mas ocorrem no alto da Serra do Mar, região que provavelmente colonizaram (a partir de florestas estacionais e cerrados do interior) em função do desmatamento e fragmentação florestal ligados à expansão da atividade antrópica. Pelo mesmo motivo, elas podem estar presentes na ilha de Santo Amaro. Outra espécie mencionada para o loteamento Iporanga – Conepatus semistriatus – não tem ocorrência comprovada nas florestas litorâneas do estado, e provavelmente foi um erro de identificação de registros indiretos, já que não houve avistamento do animal.
Daquelas espécies de mamíferos terrestres ainda não registradas na serra, a grande maioria dos pequenos roedores e marsupiais (10 espécies) tem alta probabilidade de ocorrer na área, já que esta é bastante ampla e contém habitats adequados e preservados, com heterogeneidade suficiente para conter tais populações. O levantamento de pequenos mamíferos realizado no loteamento Iporanga não foi exaustivo, contou com pequeno número de armadilhas e cobriu um número limitado de habitats, não sendo capaz de detectar diversas espécies já encontradas em fragmentos bem menores de vegetação similar amostrados no estado. Já as duas espécies listadas do gênero Phyllomys são bastante raras e não tem ocorrência provável na Serra do Guararu, ainda que a área esteja no limite de suas distribuições potenciais. Por outro lado, uma espécie adicional de roedor endêmico da mata Atlântica não listada para o levantamento de Bertioga – Delomys dorsalis – ocorre nas serras lindeiras e tem boa chance de também estar presente no Guararu.
Cinco outras espécies de mamíferos terrestres listados para a baixada de Bertioga não foram registrados no levantamento do loteamento Iporanga. Quatro deles são espécies sensíveis à caça, que podem estar extintos no local. Isso se justifica pela natureza insular da região, aliada à colonização antiga, com caça histórica e eliminação das rotas mais curtas de dispersão da fauna terrestre pela urbanização intensa das planícies e áreas onde as drenagens naturais são mais estreitas e os manguezais menores. A seguir são feitos comentários sobre as espécies em questão:
• O cateto (Pecari tajacu) é a espécie mais resiliente dentre as consideradas e ainda pode estar presente no Guararu em baixas densidades. Distribui-se por diferentes biomas da região Neotropical e sul da região Neártica, e tem ocorrência ampla e frequente por toda a Serra do Mar, inclusive em áreas fragmentadas. Tem hábito predominantemente noturno e furtivo e anda em pares ou pequenos bandos de difícil detecção. Costuma ser encontrado em fragmentos menores do que a porção florestal da Serra do Guararu e dificilmente é exterminado de uma localidade somente pela caça. Caso esteja extinta no Guararu, a espécie pode ser alvo de um programa de reintrodução monitorada, já que a área pode comportar uma população.
• A queixada (Tayassu pecari) é uma espécie de porco do mato maior do que o cateto. Apesar de ter uma distribuição geográfica bastante ampla, é sensível à caça, sendo um dos primeiros mamíferos a declinar e se extinguir em áreas colonizadas pelo homem. Vive em grandes bandos que necessitam de amplas áreas de vida, pelas quais fazem deslocamentos sazonais. A área da planície de Bertioga e Serra do Mar lindeira é um dos últimos refúgios da espécie no estado de São Paulo, mas o animal ainda sofre pressão de caça nessa região. Na ilha de Santo Amaro a espécie está provavelmente extinta, já que a colonização bastante antiga vem impondo constante pressão de caça e redução do seu habitat, e a porção remanescente na Serra do Guararu é muito pequena para manter uma população estável.
• A anta (Tapirus terrestris) é o maior mamífero Neotropical e tem distribuição ampla pelos ambientes tropicais e subtropicais da América do Sul (à exceção dos desertos). Vive solitária ou em pares e ocupa áreas da ordem de 200 a300 hectares, onde ocorre sobreposição de indivíduos. Também é bastante sensível à caça, mas por ser um animal muito grande, costuma ser menos caçado em locais onde essa atividade não é essencial para a sobrevivência humana (os caçadores acham muito trabalhoso limpar, descarnar e transportar o animal na mata e consideram muito risco fazê-lo em regiões onde a caça é proibida). Por esse motivo, ainda é bastante frequente na região da Serra do Mar e baixada litorânea. Como deixa registros evidentes, que não foram encontrados nos levantamentos realizados no loteamento Iporanga, é de se supor que esteja extinta na Serra do Guararu. Tal fato decorre provavelmente da pressão de caça histórica aliada à urbanização da baixada, que eliminou as rotas mais propícias para recolonização a partir do continente. É importante salientar que a Serra do Guararu tem área e grau de preservação suficientes para suportar uma pequena população dessa espécie, pelo que seria possível reintroduzí-la no local. Obviamente deve ser um programa de reintrodução monitorado, mas se trata de uma opção muito interessante, dada a carência cada vez maior de áreas apropriadas para a soltura de animais silvestres resgatados do tráfico, ou expulsos de seus hábitats pela expansão da atividade antrópica.
• O mono-carvoeiro (Brachyteles arachnoides) é o maior macaco das Américas, sendo endêmico da Mata Atlântica de São Paulo, Paraná, Santa Catarina e parte litorânea do sul do Rio de Janeiro. Embora careça de presença confirmada para a baixada litorânea da região de Bertioga, ocorre nas florestas de encosta adjacentes e pode ser observado no trecho cortado pelas rodovias Anchieta e Imigrantes, em frente a Serra do Guararu. Apesar de oficialmente ameaçada de extinção (listas estaduais, nacionais e UICN), a espécie ainda é caçada na região do Vale do Ribeira (onde se encontram as maiores populações remanescentes), visto que continua sendo um animal apreciado pela culinária caiçara. A espécie provavelmente ocorria na Ilha de Santo Amaro, de onde deve ter sido eliminada pela caça histórica. Como em casos anteriores, a espécie é passível de reintrodução no local.
• O Saguí-de-tufo-preto (Callithrix aurita) é endêmico da Mata Atlântica do sul e sudeste. Tem ocorrência citada para a região de Bertioga, mas é uma espécie mais característica das florestas montanas e Altomontanas da encosta e planalto. Porém, ocorre na baixada na região do Vale do Ribeira e é possível que o faça em outras partes do estado. Das cinco espécies consideradas é aquela com menor probabilidade de ter ocorrido na Serra do Guararu.
Considerando a fauna de mamíferos terrestres discutida até o momento é possível notar que, embora conte com uma mastofauna diversificada, a Serra do Guararu tem atualmente uma deficiência considerável nas guildas de dispersores e predadores de sementes. Dentre as espécies estritamente terrestres, só tem presença confirmada no local aquelas que consomem sementes de tamanho pequeno e médio (pequenos roedores, paca e cutia). Antas e queixadas estão extintas na área e o cateto provavelmente está também, ou é muito raro. Entre as espécies arborícolas que desempenham essa função, o macaco-prego e o bugio parecem ser muito raros na serra, e o mono-carvoeiro está ausente. Tal afirmação deriva dos dados do plano de manejo do loteamento Iporanga e de conversas com habitantes locais, já que os primatas são muito conspícuos e sua presença é facilmente notada pelos moradores da vizinhança. Todas as espécies consideradas são de importância vital para o equilíbrio da floresta em longo prazo, uma vez que perdam sementes e plântulas e dispersam frutos e propágulos, mediando a sucessão florestal e a distribuição da comunidade arbórea. Dessa maneira, a reintrodução monitorada de algumas espécies, como foi considerado anteriormente para o cateto, anta e mono-carvoeiro, seria bastante interessante para a manutenção da floresta da serra do Guararu (além de importante para as espécies consideradas, que carecem de habitats adequados para reintrodução, inclusive no que se refere à proteção) e deve ser considerada no manejo da área.
Já a mastofauna de carnívoros é bem representada, e as únicas espécie até o momento ausentes são o pequeno jaguarundi (Puma yagouarondi) e a onça-pintada (Panthera onca). A primeira é uma espécie pequena de ampla distribuição e difícil detecção, que pode estar presente na serra, enquanto a segunda é um predador de topo já muito raro na Serra do Mar como um todo. Ao contrário da guilda anterior, não se recomenta a reintrodução de espécies de carnívoros na área da serra.
No que se refere aos mamíferos voadores (Quirópteros), não houve nenhum inventário na área da serra do Guararu, e os dados disponíveis para o loteamento Iporanga provém de coletas e observações esporádicas. Na área foram registrados dessa maneira, dois morcegos filostomídeos - Artibeus sp e Glossophaga soricina e o Morcego-cauda-de-rato (Molossus ater). O registro de somente três espécies é irrisório para a área, que deve contar com uma diversidade similar àquela do continente adjacente, uma vez que esses animais possuem grande capacidade de deslocamento e que toda a região funciona praticamente como um habitat contínuo para eles. A Tabela 7 lista as 69 espécies de morcegos ocorrentes na baixada de Bertioga, obtida no estudo referente à criação do PE da Restinga (Fundação Florestal, WWF Brasil e Instituto Ekos, 2008), e que podem aparecer na área de interesse.
Tabela 7. Mamíferos Voadores (Quirópteros) registrados no Município de Bertioga.
| Nome Científico | Nome Popular |
| Diclidurus scutatus | Morcego-fantasma |
| Peropteryx kappleri | Morcego |
| Peropteryx macrotis | Morcego |
| Furipterus horrens | Morcego |
| Cynomops abrasus | Morcego-cara-de-cachorro |
| Cynomops planirostris | Morcego-cara-de-cachorro |
| Eumops auripendulus | Morcego-de-touca-preta |
| Eumops bonariensis | Morcego-de-touca-preta-anão |
| Eumops glaucinus | Morcego-de-touca |
| Eumops perotis | Morcego-mastiff |
| Molossops neglectus | Morcego-cara-de-cachorro |
| Molossops temminckii | Morcego-de-cara-chata |
| Molossus molossus | Morcego do telhado |
| Molossus rufus | Morcego do telhado |
| Nyctinomops aurispinosus | Morcego-de-rabo |
| Nyctinomops laticaudatus | Morcego-de-orelha-larga |
| Nyctinomops macrotis | Morcego-insetivoro-de-rabo |
| Promops nasutus | Morcego-Mastiff-marrom |
| Tadarida brasiliensis | Morcego-de-rabo-mexicano |
| Noctilio albiventris | Morcego-buldogue pequeno |
| Noctilio leporinus | Morcego pescador |
| Carollia perspicillata | Morcego-de-rabo-curto |
| Sturnira lilium | Morcego de ombro amarelo |
| Sturnira tildae | Morcego-de-ombro-amarelo |
| Desmodus rotundus | Morcego-vampiro |
| Diaemus youngi | Morcego-vampiro |
| Diphylla ecaudata | Morcego-vampiro |
| Anoura caudifer | Morcego |
| Anoura geoffroyi | Morcego-sem-rabo |
| Glossophaga soricina | Morcego-beija-flor |
| Lonchophylla mordax | Morcego-beija-flor |
| Chrotopterus auritus | Morcego |
| Glyphonycteris sylvestris | Morcego-tricolor |
| Lampronycteris brachyotis | Morcego-de-garganta-amarela |
| Lonchorhina aurita | Morcego-nariz-de-espada |
| Macrophyllum macrophyllum | Morcego-de-perna-comprida |
| Micronycteris megalotis | Morcego-orelhudo-pequeno |
| Micronycteris microtis | Morcego-de-orelha-grande |
| Mimon bennettii | Morcego-dourado |
| Phylloderma stenops | Morcego |
| Phyllostomus discolo | Morcego-ponta-de-lança-pálido |
| Phyllostomus hastatus | Morcego-ponta-de-lança |
| Tonatia bidens | Morcego |
| Trachops cirrhosus | Morcego-comedor-de-sapo |
| Artibeus cinereus | Morcego-frugívoro |
| Artibeus fimbriatus | Morcego-frugívoro |
| Artibeus lituratus | Morcego-frugívoro-comum |
| Artibeus planirostris | Morcego-frugívoro |
| Artibeus obscurus | Morcego-frugívoro-negro |
| Chiroderma doriae | Morcego-de-olho-grande |
| Platyrrhinus lineatus | Morcego-de-nariz-largo |
| Platyrrhinus recifinus | Morcego-de-nariz-largo |
| Pygoderma bilabiatum | Morcego-de-Ipanema |
| Uroderma bilobatum | Morcego-de-orelha-amarela |
| Vampyressa pusilla | Morcego-de-orelha-amarela |
| Thyroptera tricolor | Morcego-de-asa-de-disco |
| Eptesicus brasiliensis | Morcego-marrom |
| Eptesicus diminutus | Morcego-marrom-grande |
| Eptesicus furinalis | Morcego |
| Histiotus velatus | Morcego-de-orelha-grande-marrom |
| Lasiurus blossevillii | Morcego-vermelho |
| Lasiurus cinereus | Morcego-peludo |
| Lasiurus ega | Morcego-amarelo |
| Myotis albescens | Morcego-da-ponta-cinza |
| Myotis levis | Morcego-borboleta-amarelo |
| Myotis nigricans | Morcego-borboleta-preto |
| Myotis riparius | Morcego-borboleta-do-riacho |
| Myotis ruber | Morcego-borboleta-vermelho |
| Natalus stramineus | Morcego-de-orelha-de-funil |
No que se refere à avifauna, a serra do Guararu conta com os inventários realizados no estabelecimento e manejo do loteamento Iporanga, além de algumas observações pontuais. Na Tabela 8, essa listagem é comparada com os registros atribuídos para a região de Bertioga (Fundação Florestal, WWF Brasil e Instituto Ekos, 2008).
Tabela 8. Avifauna registrada no Município de Bertioga e na Serra do Guararu (Principalmente no Loteamento Iporanga).
| Nome Científico | Nome Popular | Registro no Guararu |
| Tinamidae |
|
|
| Tinamus solitarius | macuco | X |
| Crypturellus obsoletus | inhambuguaçu | X |
| Crypturellus noctivagus | jaó-do-sul |
|
| Crypturellus tataupa | inhambu-chintã | X |
| Anatidae |
|
|
| Dendrocygna bicolor | marreca-caneleira |
|
| Dendrocygna viduata | irerê |
|
| Dendrocygna autumnalis | asa-branca |
|
| Cygnus melancoryphus | cisne-de-pescoço-preto |
|
| Cairina moschata | pato-do-mato |
|
| Amazonetta brasiliensis | pé-vermelho |
|
| Anas bahamensis | marreca-toicinho |
|
| Anas versicolor | marreca-cricri |
|
| Netta erythrophthalma | paturi-preta |
|
| Netta peposaca | marrecão |
|
| Nomonyx dominica | marreca-de-bico-roxo |
|
| Cracidae |
|
|
| Penelope superciliaris | jacupemba | X |
| Penelope obscura | jacuaçu |
|
| Aburria jacutinga | jacutinga |
|
| Odontophoridae |
|
|
| Odontophorus capueira | uru |
|
| Podicipedidae |
|
|
| Tachybaptus dominicus | mergulhão-pequeno |
|
| Podilymbus podiceps | mergulhão-caçador |
|
| Podicephorus major | mergulhão-grande |
|
| Sulidae |
|
|
| Sula leucogaster | atobá-pardo | X |
| Phalacrocoracidae |
|
|
| Phalacrocorax brasilianus | biguá | X |
| Anhingidae |
|
|
| Anhinga anhinga | biguatinga |
|
| Fregatidae |
|
|
| Fregata magnificens | tesourão | X |
| Ardeidae |
|
|
| Tigrisoma lineatum | socó-boi |
|
| Cochlearius cochlearius | arapapá |
|
| Botaurus pinnatus | socó-boi-baio |
|
| Ixobrychus exilis | socoí-vermelho |
|
| Ixobrychus involucris | socoí-amarelo |
|
| Nycticorax nycticorax | savacu | X |
| Nyctanassa violacea | savacu-de-coroa |
|
| Butorides striata | socozinho | X |
| Bubulcus ibis | garça-vaqueira | X |
| Ardea cocoi | garça-moura |
|
| Ardea alba | garça-branca-grande |
|
| Syrigma sibilatrix | maria-faceira |
|
| Pilherodius pileatus | garça-real |
|
| Egretta thula | garça-branca-pequena | X |
| Egretta caerulea | garça-azul |
|
| Threskiornithidae |
|
|
| Eudocimus ruber | guará |
|
| Plegadis chihi | caraúna-de-cara-branca |
|
| Platalea ajaja | colhereiro |
|
| Ciconiidae |
|
|
| Jabiru mycteria | tuiuiú |
|
| Cathartidae |
|
|
| Cathartes aura | urubu-de-cabeça-vermelha |
|
| Coragyps atratus | urubu-de-cabeça-preta | X |
| Pandionidae |
|
|
| Pandion haliaetus | águia-pescadora |
|
| Accipitridae |
|
|
| Leptodon cayanensis | gavião-de-cabeça-cinza |
|
| Chondrohierax uncinatus | caracoleiro |
|
| Elanoides forficatus | gavião-tesoura | X |
| Elanus leucurus | gavião-peneira |
|
| Ictinea plumbea | sovi | X |
| Rostrhamus sociabilis | gavião-caramujeiro |
|
| Harpagus diodon | gavião-bombachinha |
|
| Accipiter poliogaster | tauató-pintado |
|
| Accipiter striatus | gaviaõzinho | X |
| Geranospiza caerulescens | gavião-pernilongo |
|
| Leucopternis lacernulatus | gavião-pombo-pequeno |
|
| Buteogallus aequinoctialis | caranguejeiro |
|
| Buteogallus urubitinga | gavião-preto |
|
| Heterospizias meridionalis | gavião-caboclo |
|
| Parabuteo unicinctus | gavião-asa-de-telha |
|
| Rupornis magnirostris | gavião-carijó | X |
| Buteo albicaudatus | gavião-de-rabo-branco |
|
| Buteo brachyurus | gavião-de-cauda-curta |
|
| Spizaetus tyrannus | gavião-pega-macaco |
|
| Falconidae |
|
|
| Caracara plancus | caracará | X |
| Milvago chimachima | carrapateiro | X |
| Milvago chimango | chimango |
|
| Herpetotheres cachinnans | acauã | X |
| Micrastur ruficollis | falcão-caburé |
|
| Micrastur semitorquatus | falcão-relógio |
|
| Falco sparverius | quiriquiri |
|
| Falco femoralis | falcão-de-coleira | X |
| Falco peregrinus | falcão-peregrino |
|
| Aramidae |
|
|
| Aramus guarauna | carão |
|
| Rallidae |
|
|
| Rallus longirostris | saracura-matraca |
|
| Aramides mangle | saracura-do-mangue |
|
| Aramides cajanea | saracura-três-potes | X |
| Aramides saracura | saracura-do-mato |
|
| Amaurolimnas concolor | saracura-lisa |
|
| Laterallus melanophaius | sanã-parda | X |
| Laterallus leucopyrrhus | sanã-vermelha |
|
| Porzana flaviventer | sanã-amarela |
|
| Porzana albicollis | sanã-carijó |
|
| Neocrex erythrops | turu-turu |
|
| Pardirallus nigricans | saracura-sanã |
|
| Gallinula chloropus | frango-d'água-comum |
|
| Gallinula melanops | frango-d'água-carijó |
|
| Porphyrio martinica | frango-d'água-azul |
|
| Fulica armillata | carqueja-de-bico-manchado |
|
| Charadriidae |
|
|
| Vanellus chilensis | quero-quero | X |
| Pluvialis dominica | batuiruçu |
|
| Pluvialis squatarola | batuiruçu-de-axila-preta |
|
| Charadrius semipalmatus | batuíra-de-bando | X |
| Charadrius collaris | batuíra-de-coleira |
|
| Charadrius modestus | batuíra-de-peito-tijolo |
|
| Haematopodidae |
|
|
| Haematopus palliatus | piru-piru |
|
| Recurvirostridae |
|
|
| Himantopus melanurus | pernilongo-de-costas-brancas |
|
| Scolopacidae |
|
|
| Gallinago paraguaiae | narceja |
|
| Limosa haemastica | maçarico-de-bico-virado |
|
| Actitis macularius | maçarico-pintado | X |
| Tringa solitaria | maçarico-solitário |
|
| Tringa melanoleuca | maçarico-grande-de-perna-amarela |
|
| Tringa semipalmata | maçarico-de-asa-branca |
|
| Tringa flavipes | maçarico-de-perna-amarela |
|
| Arenaria interpres | vira-pedras |
|
| Calidris pusilla | maçarico-rasteirinho |
|
| Calidris fuscicollis | maçarico-de-sobre-branco |
|
| Jacanidae |
|
|
| Jacana jacana | jaçanã | X |
| Laridae |
|
|
| Larus dominicanus | gaivotão |
|
| Sternidae |
|
|
| Sternula superciliaris | trinta-réis-anão |
|
| Phaetusa simplex | trinta-réis-grande |
|
| Gelochelidon nilotica | trinta-réis-de-bico-preto |
|
| Sterna hirundo | trinta-réis-boreal |
|
| Sterna hirundinacea | trinta-réis-de-bico-vermelho |
|
| Sterna trudeaui | trinta-réis-de-coroa-branca |
|
| Thalasseus sandvicensis | trinta-réis-de-bando |
|
| Thalasseus maximus | trinta-réis-real |
|
| Rynchopidae |
|
|
| Rynchops niger | talha-mar |
|
| Columbidae |
|
|
| Columbina talpacoti | rolinha-roxa | X |
| Columbina squammata | fogo-apagou |
|
| Claravis pretiosa | pararu-azul |
|
| Columba livia | pombo-doméstico | X |
| Patagioenas picazuro | pombão |
|
| Patagioenas cayennensis | pomba-galega | X |
| Patagioenas plumbea | pomba-amargosa | X |
| Leptotila verreauxi | juriti-pupu | X |
| Leptotila rufaxilla | juriti-gemedeira |
|
| Geotrygon montana | pariri | X |
| Psittacidae |
|
|
| Pyrrhura frontalis | tiriba-de-testa-vermelha | X |
| Forpus xanthopterygius | tuim | X |
| Brotogeris tirica | periquito-rico | X |
| Touit melanonotus | apuim-de-costas-pretas |
|
| Touit surdus | apuim-de-cauda-amarela |
|
| Pionopsitta pileata | cuiú-cuiú | X |
| Pionus maximiliani | maitaca-verde | X |
| Amazona amazonica | curica |
|
| Amazona farinosa | papagaio-moleiro |
|
| Triclaria malachitacea | sabiá-cica | X |
| Cuculidae |
|
|
| Piaya cayana | alma-de-gato | X |
| Coccyzus melacoryphus | papa-lagarta-acanelado | X |
| Coccyzus americanus | papa-lagarta-de-asa-vermelha |
|
| Crotophaga major | anu-coroca |
|
| Crotophaga ani | anu-preto | X |
| Guira guira | anu-branco | X |
| Tapera naevia | saci |
|
| Dromococcyx pavoninus | peixe-frito-pavonino |
|
| Strigidae |
|
|
| Megascops choliba | corujinha-do-mato | X |
| Megascops atricapilla | corujinha-sapo |
|
| Megascops sp |
|
|
| Pulsatrix koeniswaldiana | murucututu-de-barriga-amarela |
|
| Strix virgata | coruja-do-mato |
|
| Glaucidium minutissimum | caburé-miudinho |
|
| Glaucidium brasilianum | caburé |
|
| Athene cunicularia | coruja-buraqueira | X |
| Pseudoscops clamator | coruja-orelhuda | X |
| Nyctibiidae |
|
|
| Nyctibius aethereus | mãe-da-lua-parda |
|
| Nyctibius griseus | mãe-da-lua |
|
| Caprimulgidae |
|
|
| Lurocalis semitorquatus | tuju |
|
| Chordeiles acutipennis | bacurau-de-asa-fina |
|
| Podager nacunda | corucão |
|
| Nyctidromus albicollis | bacurau | X |
| Caprimulgus parvulus | bacurau-chintã |
|
| Hydropsalis torquata | bacurau-tesoura |
|
| Macropsalis forcipata | bacurau-tesoura-gigante |
|
| Apodidae |
|
|
| Cypseloides fumigatus | taperuçu-preto |
|
| Streptoprocne zonaris | taperuçu-de-coleira-branca |
|
| Chaetura cinereiventris | andorinhão-de-sobre-cinzento | X |
| Chaetura meridionalis | andorinhão-do-temporal |
|
| Panyptila cayennensis | andorinhão-estofador |
|
| Trochilidae |
|
|
| Ramphodon naevius | beija-flor-rajado | X |
| Glaucis hirsutus | balança-rabo-de-bico-torto |
|
| Phaethornis squalidus | rabo-branco-pequeno |
|
| Phaethornis ruber | rabo-branco-rubro |
|
| Phaethornis eurynome | rabo-branco-de-garganta-rajada | X |
| Eupetomena macroura | beija-flor-tesoura | X |
| Aphantochroa cirrochloris | beija-flor-cinza |
|
| Florisuga fusca | beija-flor-preto | X |
| Anthracothorax nigricollis | beija-flor-de-veste-preta |
|
| Lophornis chalybeus | topetinho-verde | X |
| Polytmus guainumbi | beija-flor-de-bico-curvo | X |
| Thalurania glaucopis | beija-flor-de-fronte-violeta | X |
| Hylocharis cyanus | beija-flor-roxo | X |
| Leucochloris albicollis | beija-flor-de-papo-branco |
|
| Amazilia versicolor | beija-flor-de-banda-branca |
|
| Amazilia fimbriata | beija-flor-de-garganta-verde | X |
| Amazilia lactea | Beija-flor-de-papo-branco | X |
| Trogonidae |
| X |
| Trogon viridis | surucuá-grande-de-barriga-amarela | X |
| Trogon rufus | surucuá-de-barriga-amarela |
|
| Alcedinidae |
|
|
| Megaceryle torquata | martim-pescador-grande | X |
| Chloroceryle amazona | martim-pescador-verde |
|
| Chloroceryle aenea | martinho |
|
| Chloroceryle americana | martim-pescador-pequeno | X |
| Chloroceryle inda | martim-pescador-da-mata | X |
| Momotidae |
|
|
| Baryphthengus ruficapillus | juruva-verde | X |
| Galbulidae |
|
|
| Galbula ruficauda | ariramba-de-cauda-ruiva |
|
| Bucconidae |
|
|
| Notharchus macrorhynchos | macuru-de-testa-branca |
|
| Notharchus swainsoni | macuru-de-barriga-castanha |
|
| Malacoptila striata | barbudo-rajado | X |
| Ramphastidae |
|
|
| Ramphastos vitellinus | tucano-de-bico-preto | X |
| Ramphastos dicolorus | tucano-de-bico-verde | X |
| Selenidera maculirostris | araçari-poca | X |
| Pteroglossus bailloni | araçari-banana | X |
| Picidae |
|
|
| Picumnus cirratus | pica-pau-anão-barrado |
|
| Picumnus temminckii | pica-pau-anão-de-coleira | X |
| Melanerpes flavifrons | benedito-de-testa-amarela |
|
| Veniliornis spilogaster | picapauzinho-verde-carijó | X |
| Piculus flavigula | pica-pau-bufador |
|
| Colaptes melanochloros | pica-pau-verde-barrado |
|
| Colaptes campestris | pica-pau-do-campo |
|
| Celeus flavescens | pica-pau-de-cabeça-amarela | X |
| Dryocopus lineatus | pica-pau-de-banda-branca |
|
| Campephilus robustus | pica-pau-rei | X |
| Thamnophilidae |
|
|
| Hypoedaleus guttatus | chocão-carijó |
|
| Batara cinerea | matracão |
|
| Mackenziaena severa | borralhara |
|
| Biatas nigropectus | papo-branco |
|
| Thamnophilus caerulescens | choca-da-mata | X |
| Thamnophilus ruficapillus | choca-de-chapéu-vermelho |
|
| Dysithamnus stictothorax | choquinha-de-peito-pintado | X |
| Dysithamnus mentalis | choquinha-lisa | X |
| Myrmotherula gularis | choquinha-de-garganta-pintada |
|
| Myrmotherula minor | choquinha-pequena |
|
| Myrmotherula unicolor | choquinha-cinzenta | X |
| Herpsilochmus rufimarginatus | chorozinho-de-asa-vermelha |
|
| Drymophila ferruginea | trovoada | X |
| Drymophila ochropyga | choquinha-de-dorso-vermelho |
|
| Drymophila squamata | pintadinho | X |
| Terenura maculata | zidedê |
|
| Pyriglena leucoptera | papa-taoca-do-sul | X |
| Myrmeciza squamosa | papa-formiga-de-grota | X |
| Conopophagidae |
|
|
| Conopophaga lineata | chupa-dente |
|
| Conopophaga melanops | cuspidor-de-máscara-preta | X |
| Grallariidae |
|
|
| Grallaria varia | tovacuçu |
|
| Rhinocryptidae |
|
|
| Psilorhamphus guttatus | tapaculo-pintado |
|
| Merulaxis ater | entufado | X |
| Scytalopus indigoticus | macuquinho |
|
| Formicariidae |
|
|
| Formicarius colma | galinha-do-mato | X |
| Chamaeza campanisona | tovaca-campainha | X |
| Chamaeza meruloides | tovaca-cantadora |
|
| Scleruridae |
|
|
| Sclerurus mexicanus | vira-folha-de-peito-vermelho |
|
| Sclerurus scansor | vira-folha | X |
| Dendrocolaptidae |
|
|
| Dendrocincla turdina | arapaçu-liso | X |
| Sittasomus griseicapillus | arapaçu-verde | X |
| Xiphocolaptes albicollis | arapaçu-de-garganta-branca |
|
| Dendrocolaptes platyrostris | arapaçu-grande | X |
| Xiphorhynchus fuscus | arapaçu-rajado |
|
| Lepidocolaptes falcinellus | arapaçu-escamado-do-sul |
|
| Lepidocolaptes squamatus | arapaçu-escamado | X |
| Furnariidae |
|
|
| Furnarius rufus | joão-de-barro | X |
| Synallaxis ruficapilla | pichororé | X |
| Synallaxis spixi | joão-teneném |
|
| Cranioleuca pallida | arredio-pálido |
|
| Certhiaxis cinnamomeus | curutié |
|
| Phacellodomus erythrophthalmus | joão-botina-da-mata |
|
| Philydor lichtensteini | limpa-folha-ocráceo | X |
| Philydor atricapillus | limpa-folha-coroado |
|
| Philydor rufum | limpa-folha-de-testa-baia | X |
| Anabazenops fuscus | trepador-coleira |
|
| Cichlocolaptes leucophrus | trepador-sobrancelha |
|
| Automolus leucophthalmus | barranqueiro-de-olho-branco | X |
| Lochmias nematura | joão-porca | X |
| Xenops minutus | bico-virado-miúdo | X |
| Xenops rutilans | bico-virado-carijó |
|
| Tyrannidae |
|
|
| Mionectes rufiventris | abre-asa-de-cabeça-cinza | X |
| Leptopogon amaurocephalus | cabeçudo |
|
| Hemitriccus orbitatus | tiririzinho-do-mato | X |
| Hemitriccus nidipendulus | tachuri-campainha |
|
| Hemitriccus furcatus | papa-moscas-estrela |
|
| Todirostrum poliocephalum | teque-teque |
|
| Todirostrum cinereum | ferreirinho-relógio | X |
| Phyllomyias burmeisteri | piolhinho-chiador |
|
| Phyllomyias fasciatus | piolhinho |
|
| Phyllomyias griseocapilla | piolhinho-serrano |
|
| Myiopagis caniceps | guaracava-cinzenta |
|
| Elaenia flavogaster | guaracava-de-barriga-amarela | X |
| Elaenia parvirostris | guaracava-de-bico-curto |
|
| Elaenia obscura | Lafresnaye, |
|
| Camptostoma obsoletum | risadinha | X |
| Phylloscartes paulista | não-pode-parar |
|
| Phylloscartes oustaleti | papa-moscas-de-olheiras |
|
| Phylloscartes sylviolus | maria-pequena |
|
| Myiornis auricularis | miudinho | X |
| Tolmomyias sulphurescens | bico-chato-de-orelha-preta | X |
| Tolmomyias flaviventris | bico-chato-amarelo | X |
| Platyrinchus mystaceus | patinho | X |
| Platyrinchus leucoryphus | patinho-gigante |
|
| Onychorhynchus swainsoni | maria-leque-do-sudeste |
|
| Myiophobus fasciatus | filipe |
|
| Myiobius barbatus | assanhadinho |
|
| Hirundinea ferruginea | gibão-de-couro |
|
| Lathrotriccus euleri | enferrujado |
|
| Cnemotriccus fuscatus | guaracavuçu |
|
| Contopus cinereus | papa-moscas-cinzento |
|
| Pyrocephalus rubinus | príncipe |
|
| Knipolegus nigerrimus | maria-preta-de-garganta-vermelha |
|
| Satrapa icterophrys | suiriri-pequeno |
|
| Fluvicola pica | lavadeira-do-norte |
|
| Fluvicola nengeta | lavadeira-mascarada |
|
| Arundinicola leucocephala | freirinha |
|
| Colonia colonus | viuvinha |
|
| Machetornis rixosa | suiriri-cavaleiro | X |
| Legatus leucophaius | bem-te-vi-pirata | X |
| Myiozetetes similis | bentevizinho-de-penacho-vermelho |
|
| Pitangus sulphuratus | bem-te-vi | X |
| Philohydor lictor | bentevizinho-do-brejo |
|
| Conopias trivirgatus | bem-te-vi-pequeno |
|
| Myiodynastes maculatus | bem-te-vi-rajado |
|
| Megarynchus pitangua | neinei | X |
| Empidonomus varius | peitica |
|
| Tyrannus melancholicus | suiriri | X |
| Tyrannus savana | tesourinha |
|
| Rhytipterna simplex | vissiá |
|
| Sirystes sibilator | gritador | X |
| Myiarchus swainsoni | irré |
|
| Myiarchus ferox | maria-cavaleira | X |
| Attila phoenicurus | capitão-castanho |
|
| Attila rufus | capitão-de-saíra |
|
| Cotingidae |
|
|
| Carpornis melanocephala | sabiá-pimenta |
|
| Procnias nudicollis | araponga | X |
| Pyroderus scutatus | pavó | X |
| Pipridae |
|
|
| Ilicura militaris | tangarazinho |
|
| Manacus manacus | rendeira | X |
| Chiroxiphia caudata | tangará | X |
| Tityridae |
|
|
| Oxyruncus cristatus | araponga-do-horto |
|
| Schiffornis virescens | flautim |
|
| Laniisoma elegans | chibante |
|
| Iodopleura pipra | anambezinho |
|
| Tityra inquisitor | anambé-branco-de-bochecha-parda |
|
| Tityra cayana | anambé-branco-de-rabo-preto |
|
| Pachyramphus viridis | caneleiro-verde |
|
| Pachyramphus castaneus | caneleiro |
|
| Pachyramphus polychopterus | caneleiro-preto |
|
| Pachyramphus marginatus | caneleiro-bordado |
|
| Pachyramphus validus | caneleiro-de-chapéu-preto |
|
| Vireonidae |
|
|
| Cyclarhis gujanensis | pitiguari | X |
| Vireo olivaceus | juruviara |
|
| Hylophilus thoracicus | vite-vite |
|
| Hirundinidae |
|
|
| Tachycineta leucorrhoa | andorinha-de-sobre-branco |
|
| Progne subis | andorinha-azul |
|
| Progne chalybea | andorinha-doméstica-grande | X |
| Pygochelidon cyanoleuca | andorinha-pequena-de-casa | X |
| Neochelidon tibialis | calcinha-branca |
|
| Stelgidopteryx ruficollis | andorinha-serradora |
|
| Hirundo rustica | andorinha-de-bando |
|
| Troglodytidae |
|
|
| Troglodytes musculus | corruíra | X |
| Cistothorus platensis | corruíra-do-campo |
|
| Cantorchilus longirostris | garrinchão-de-bico-grande | X |
| Donacobiidae |
|
|
| Donacobius atricapilla | japacanim |
|
| Polioptilidae |
|
|
| Ramphocaenus melanurus | bico-assovelado |
|
| Turdidae |
|
|
| Turdus flavipes | sabiá-una | X |
| Turdus rufiventris | sabiá-laranjeira | X |
| Turdus leucomelas | sabiá-barranco | X |
| Turdus amaurochalinus | sabiá-poca |
|
| Turdus albicollis | sabiá-coleira | X |
| Mimidae |
|
|
| Mimus saturninus | sabiá-do-campo |
|
| Motacillidae |
|
|
| Anthus lutescens | caminheiro-zumbidor |
|
| Coerebidae |
|
|
| Coereba flaveola | cambacica | X |
| Thraupidae |
|
|
| Cissopis leverianus | tietinga |
|
| Orthogonys chloricterus | catirumbava |
|
| Thlypopsis sordida | saí-canário |
|
| Trichothraupis melanops | tiê-de-topete |
|
| Habia rubica | tiê-do-mato-grosso |
|
| Tachyphonus cristatus | tiê-galo | X |
| Tachyphonus coronatus | tiê-preto |
|
| Ramphocelus bresilius | tiê-sangue | X |
| Thraupis sayaca | sanhaçu-cinzento | X |
| Thraupis cyanoptera | sanhaçu-de-encontro-azul |
|
| Thraupis ornata | sanhaçu-de-encontro-amarelo |
|
| Thraupis palmarum | sanhaçu-do-coqueiro | X |
| Pipraeidea melanonota | saíra-viúva |
|
| Tangara seledon | saíra-sete-cores | X |
| Tangara cyanocephala | saíra-militar | X |
| Tangara peruviana | saíra-sapucaia |
|
| Tersina viridis | saí-andorinha |
|
| Dacnis cayana | saí-azul | X |
| Chlorophanes spiza | saí-verde |
|
| Hemithraupis ruficapilla | saíra-ferrugem | X |
| Conirostrum speciosum | figuinha-de-rabo-castanho |
|
| Conirostrum bicolor | figuinha-do-mangue |
|
| Emberizidae |
|
|
| Zonotrichia capensis | tico-tico | X |
| Haplospiza unicolor | cigarra-bambu |
|
| Sicalis flaveola | canário-da-terra-verdadeiro |
|
| Volatinia jacarina | tiziu | X |
| Sporophila frontalis | pixoxó |
|
| Sporophila collaris | coleiro-do-brejo |
|
| Sporophila nigricollis | baiano |
|
| Sporophila caerulescens | coleirinho | X |
| Sporophila angolensis | curió |
|
| Tiaris fuliginosus | cigarra-do-coqueiro |
|
| Cardinalidae |
|
|
| Saltator fuliginosus | pimentão | X |
| Saltator similis | trinca-ferro-verdadeiro | X |
| Parulidae |
|
|
| Parula pitiayumi | mariquita | X |
| Geothlypis aequinoctialis | pia-cobra | X |
| Basileuterus culicivorus | pula-pula | X |
| Phaeothlypis rivularis | pula-pula-ribeirinho |
|
| Icteridae |
|
|
| Psarocolius decumanus | japu |
|
| Cacicus haemorrhous | guaxe | X |
| Agelasticus cyanopus | carretão |
|
| Chrysomus ruficapillus | garibaldi |
|
| Pseudoleistes guirahuro | chopim-do-brejo |
|
| Molothrus oryzivorus | iraúna-grande |
|
| Molothrus bonariensis | vira-bosta | X |
| Sturnella militaris | polícia-inglesa-do-norte |
|
| Sturnella superciliaris | polícia-inglesa-do-sul |
|
| Fringillidae |
|
|
| Euphonia violacea | gaturamo-verdadeiro | X |
| Euphonia chalybea | cais-cais |
|
| Euphonia cyanocephala | gaturamo-rei |
|
| Euphonia pectoralis | ferro-velho | X |
| Euphonia chlorotica | fim-fim | X |
| Chlorophonia cyanea | Bandeirinha |
|
| Estrildidae |
|
|
| Estrilda astrild | bico-de-lacre | X |
| Passeridae |
|
|
| Passer domesticus | Pardal | X |
As espécies observadas até o momento na serra do Guararu chegam a 149, que corresponde a cerca de 35% do número de aves registrado para a região. No entanto, esse número é certamente maior, porque ambientes estuarinos, restingas e florestas de baixada estão subamostrados na referida serra, já que tais habitats são bem restritos ou estão muito alterados na área do loteamento Iporanga. Do mesmo modo, as cotas mais altas da serra do Guararu também estão subamostradas pelo referido levantamento. Também foram pouco computadas as aves marinhas que visitam as praias e costões da área estudada. Entre aquelas presentes destacam-se uma série de espécies ameaçadas e quase ameaçadas mencionadas na Tabela 9, abaixo, que inclui aves e mamíferos (grupos melhor inventariados na área estudada).
Tabela 9. Relação das Espécies da Fauna Ameaçada de Extinção no Estado (SP) e na Lista Nacional (IBAMA) Observadas na Área de Preservação Ecológica na Serra do Guararu (Loteamento Iporanga).
| ESPÉCIE | NOME POPULAR | STATUS |
| Merulaxis ater | Bigodudo-preto | AM – IBAMA, SP |
| Pionopsita pileata | Cuiú-cuiú | AM - SP |
| Procnias nudicolis | Araponga | AM - SP |
| Pyroderus scutatus | Pavó | AM - SP |
| Ramphodon naevius | Beija-flor-rajado | AM- IBAMA, SP |
| Tinamus solitarius | Macuco | AM – IBAMA, SP |
| Triclaria malachitacea | Sabiá-cica | AM – IBAMA, SP |
| Alouatta fusca | Bugio | AM - SP |
| Chironectes minimus | Cuíca-d’água | AM - SP |
| Kannabateomus amblyonyx | Rato-da-taquara | AM - SP |
Como no caso dos mamíferos discutidos anteriormente, a serra do Guararu se mostra um local propício para a soltura e reintrodução de espécies de aves. No caso, a mais interessante seria a jacutinga (Aburria jacutinga), que se encontra extinta em grande parte da sua área de distribuição. A área da serra é grande, contém uma população numerosa de palmito-juçara (Euterpe edulis) que é uma das suas principais fontes de alimento, relativamente protegida e seria de fácil monitoramento.
Outros grupos da fauna de vertebrados contam somente com registros pontuais na área da serra do Guararu. Para os répteis foram registradas 13 espécies, sendo dez serpentes e três lagartos. Entre as serpentes, as espécies observadas foram Chironius multiventris, Liophis miliaris, Oxyrhopus petola, Siphlophis pulcher, Spilotes pullatus, Sordellina punctata e Echinanthera bilineata da família Colubridae, e as peçonhentas Micrurus corallinus da família Elapidae e Bothrops jararaca e B. jararacussu da família Viperidae. Já entre os lagartos, registrou-se o leiosaurídeo Enyialius iheringii e o gimnoftalmídeo Placosoma glabellum,endêmicos das florestas litorâneas do sudeste/sul do país, e o teídeo Tupinambis merianae,de distribuição mais ampla.
Já para os anfíbios, os registros de espécies são ainda mais escassos, e somente os anuros Aplastodiscus albofrenatus, Hypsiboas albomarginatus, H. faber, Dendropsophus minutus, Scinax fuscuvarius, Thoropa miliaris e Rhinella ornata foram registrados na serra e arredores.
Ainda que o número de espécies já registrado seja baixo, a serra do Guararu contém ambientes propícios para abrigar populações de praticamente todas as espécies de répteis e anfíbios conhecidas para a região litorânea do centro norte do estado. As Tabelas 10 e 11apresentam respectivamente as listas dessas espécies, baseada no levantamento da Fundação Florestal, WWF Brasil e Instituto Ekos(2008), acrescido de observações feitas nos municípios de São Sebastião, Ilhabela, Caraguatatutuba e Ubatuba. Ao todo, 45 espécies de anfíbios e 55 espécies de répteis têm ocorrência potencial na área da serra do Guararu. Porém, ressalta-se que, em função das suas características topográficas, além das espécies características da baixada, na área também podem ocorrer alguns répteis e anfíbios típicos de florestas de encosta montanas, o que elevaria ainda mais o número de espécies potencialmente encontradas.
Tabela 10. Anfíbios Registrados nas Planícies Litorâneas do Centro e Norte do Estado de São Paulo, com Ocorrência Potencial na Serra do Guararu.
| Ordem Anura |
| Família Amphignathodontidae |
| Flectonotus fissilis |
| Família Brachycephalidae |
| Eleutherodactylus binotatus |
| Ischnocnema guentheri |
| Ischnocnema parva |
| Ischnocnema cf. randorum |
| Família Bufonidae |
| Dendrophryniscus brevipollicatus |
| Rhinella hoogmoedi |
| Rhinella icterica |
| Rhinella ornata |
| Familia Centrolenidae |
| Hyalinobatrachium eurygnathum |
| Hyalinobatrachium uranoscopum |
| Família Cycloramphidae |
| Cycloramphus boraceiensis |
| Cycloramphus dubius |
| Macrogenioglotus alipioi |
| Proceratophrys appendiculata |
| Thoropa miliaris |
| Família Hylidae |
| Aplastodiscus eugenioi |
| Aplastodiscus albofrenatus |
| Bokermannohyla hylax |
| Dendropsophus berthalutzae |
| Dendropsophus elegans |
| Dendropsophus minutus |
| Hypsiboas faber |
| Hypsiboas albomarginatus |
| Hypsiboas pardalis |
| Hypsiboas semilineatus |
| Itapotihyla langsdorffii |
| Phasmahyla guttata |
| Scinax alter |
| Scinax angrensis |
| Scinax argerionatus |
| Scinax fuscovarius |
| Scinax littoralis |
| Scinax gr. perpusillus |
| Trachycephalus mesophaeus |
| Família Hylodidae |
| Hylodes asper |
| Hylodes phyllodes |
| Família Leiuperidae |
| Physalaemus bokermanni |
| Physalaemus moreirae. |
| Família Leptodactylidae |
| Leptodactylus fuscus |
| Leptodactylus marmoratus |
| Leptodactylus ocellatus |
| Família Microhylidae |
| Chiasmocleis atlantica |
| Myersiella microps |
| Gymnophiona |
| Família Caeciliida |
| Siphonops paulensis |
Tabela 11. Répteis Registrados nas Planícies Litorâneas do Centro e Norte do Estado de São Paulo, com Ocorrência Potencial na Serra do Guararu.
| Squamata |
| Família Amphisbaenidae |
| Leposternon microcephalum |
| Família Anguidae |
| Ophiodes fragilis |
| Família Gekkonidae |
| Gymnodactylus darwinii |
| Hemidactylus mabouia |
| Família Gymnophthalmidae |
| Ecpleopus gaudichaudii |
| Placosoma glabellum. |
| Família Polychrotidae |
| Polychrus marmoratus |
| Família Leiosauridae |
| Enyalius iheringii |
| Enyalius perditus |
| Família Scincidae |
| Mabuya caissara |
| Mabuya macrorhyncha |
| Família Tropiduridae |
| Tropidurus torquatus |
| Família Teiidae |
| Tupinambis merianae |
| Familia Boidae |
| Corallus hortulanus |
| Família Colubridae |
| Chironius bicarinatus |
| Chironius exoletus |
| Chironius foveatus |
| Chironius fuscus |
| Chironius laevicollis |
| Chironius multiventris |
| Clelia plúmbea |
| Dipsas albifrons |
| Dipsas alternans |
| Dipsas neivai |
| Dipsas indica |
| Echinanthera bilineata |
| Echinanthera cephalostriata |
| Echinanthera undulata |
| Erythrolamprus aesculapii |
| Imantodes cenchoa |
| Liophis jaegeri |
| Liophis miliaris |
| Liophis poecilogyrus |
| Mastigodryas bifossatus |
| Oxyrhopus clathratus |
| Oxyrhopus guibei |
| Oxyrhopus petola |
| Philodryas patagoniensis |
| Sibynomorphus neuwiedi |
| Siphlophis longicaudatus |
| Siphlophis pulcher |
| Sordellina punctata |
| Spilotes pullatus |
| Thamnodynastes nattereri |
| Tomodon dorsatus |
| Tropidodryas serra |
| Tropidodryas striaticeps |
| Waglerophis merremii |
| Xenodon neuwiedii |
| Xenopholis sp. |
| Família Elapidae |
| Micrurus corallinus |
| Família Viperidae |
| Bothrops jararaca |
| Bothrops jararacussu |
| Testudines |
| Famíla Chelidae |
| Hydromedusa tectifera |
| Crocodylia |
| Família Alligatoridae |
| Caiman latirostris |
Para os peixes de água doce não há qualquer informação das espécies presentes na serra do Guararu. A área conta com inúmeros riachos de corredeira e até cursos d’água de maior porte, como na baixada da Prainha. Nesses ambientes seria esperado encontrar várias das espécies endêmicas comumente observadas na área litorânea, e se faz necessário um inventário dirigido para o grupo.
Por fim, cabe mencionar a fauna de invertebrados terrestres abrigada na serra. As florestas atlânticas de encosta e planície do estado de São Paulo contêm grande número de espécies de invertebrados, com variada fauna de moluscos gastrópodes, aracnídeos, miriápodes, crustáceos associados aos ambientes fluviais e principalmente insetos. Nesse último grupo se destacam coleópteros e lepidópteros como os detentores de maior diversidade, com mais de 1.000 espécies registradas para a área como um todo. Nenhum inventário exaustivo desses grupos foi realizado numa localidade específica e as referidas faunas continuam subamostradas e mal conhecidas no que se refere à distribuição biogeográfica e ecológica das espécies. Um dos poucos grupos melhor amostrados na baixada litorânea é o das borboletas, que são na verdade um subgrupo de Lepidoptera. Os pesquisadores Ronaldo Francini e André Freitas têm realizado inventários mais sistemáticos da fauna de borboletas da baixada santista, que culminaram com a publicação notas de história natural das espécies em Francini (2010) e da lista mais atual, em Francini et all. (2011). Ao todo, 538 espécies de borboletas foram registrada para a região da baixada santista nos referidos trabalhos e a lista de espécies se encontra em Francini et all. (2011). Dadas as condições ambientais e localização geográfica da serra do Guararu, pode-se antever que a maior parte, senão todas as espécies listadas têm ocorrência potencial na área.
voltar ao topo
4.2.2.3. Considerações Finais
Embora não haja muitos dados coletados diretamente na Serra do Guararu, a área se insere numa região ainda bem preservada, com significativos registros de fauna silvestre, que incluem várias espécies endêmicas e ameaçadas de extinção. Dados coletados no loteamento Iporanga, dentro da Serra do Guararu, mostram que boa parte das espécies de aves e mamíferos observadas na porção continental da planície litorânea ocorre no maciço, e que existe potencial para ocorrência para a grande maioria das espécies de outros grupos de vertebrados e invertebrados registradas em pontos vizinhos ao longo da Baixada Santista. Porém, inventários complementares se fazem necessários, já que boa parte da área não foi amostrada para os dois primeiros grupos mencionados e os demais vertebrados sequer foram inventariados na serra. Além dos vertebrados, alguns grupos invertebrados melhor conhecidos, como as borboletas, besouros e himenópteros, poderiam ser amostrados na área do Guararu para que se conheça melhor os padrões biogeográficos preponderantes na área.
Embora tenha uma fauna diversificada, a serra do Guararu já perdeu espécies (notadamente de aves e mamíferos) em função da ocupação e exploração pretérita, e carece de alguns elementos importantes em guildas chave para a manutenção da floresta em longo prazo. Entretanto, as condições de preservação e governança territorial exibidas pela área a tornam um local ideal para a reintrodução monitorada dessas espécies, que incluem animais ameaçados de extinção com pouco habitat disponível, tais como o mono-carvoeiro e a jacutinga.
4.3. Socioeconomia
4.3.1. Diagnóstico Regional: o município do Guarujá
4.3.1.1. Aspectos Históricos
De acordo com a Fundação SEADE (1986), a ocupação do território, hoje conhecido como Guarujá (em tupi guarani, “viveiro de guarus”, “peixe de água doce”) remonta a 1534, com a doação, pelo rei de Portugal D. João III a Pero Lopes de Souza, de uma ilha denominada pelos índios de Guaibê, ou Guaimbê, a “ilha do sol”, posteriormente chamada de Ilha de Santo Amaro. A fixação de colonos nestas terras foi, inicialmente, prejudicada pela conformação montanhosa e proximidade de outros núcleos mais importantes. Porém, sempre desempenhou papel estratégico no sistema de defesa da Baixada Santista. Em 1552 foi construído no extremo norte da ilha (na Ponta da Armação) o Forte de São Felipe, já em 1584, iniciou-se a construção da fortaleza da Barra Grande, no extremo sul da ilha e datam de 1660 as primeiras referências à fortaleza de Itapema, localizada no bairro atual de Vicente de Carvalho. No entanto, somente nas primeiras décadas do século XX, a cidade de Guarujá passou a se desenvolver como vila balneária, época em que Elias Fausto Pacheco Jordão mandou vir da Geórgia, Estados Unidos, 46 chalés de madeira desmontados, iniciando a construção de um hotel, uma igreja e um cassino. Tornou-se distrito do município de Santos em 26 de outubro de 1922 e, em 30 de dezembro de 1926, foi criada a prefeitura sanitária de Guarujá, extinta cinco anos depois pelo então interventor federal no Estado de São Paulo. Guarujá foi reconduzida à condição de distrito de Santos em 23 de janeiro de 1931 e só retomou sua autonomia em 30 de junho de 1934, quando foi reconhecida oficialmente como estância balneária.
No século XIX, a ocupação urbana do município tomou vulto pela orla marítima, área com potencial paisagístico destinada a constituir-se em balneário da alta sociedade paulista e que, nas últimas décadas, sofreu grande expansão imobiliária. Posteriormente surgiu o Distrito de Vicente de Carvalho com o bairro de Itapema. Desenvolveu-se ao redor do cais das barcas de ligação ao porto de Santos e da estação ferroviária, de onde partia a linha férrea para o centro do Guarujá.
Por volta de 1957, por ocasião do desabamento dos morros santistas, numerosas famílias transferiram-se maciçamente para o Sítio “Paecará”, expandindo a população de Vicente de Carvalho. O desenvolvimento do município prosseguiu com a abertura dos loteamentos ao longo da Via Dumont.
voltar ao topo
4.3.1.2. Aspectos Populacionais
A população (residente) do município de Guarujá está estimada em 290.752 habitantes (IBGE, 2010a), distribuída por um território de 142,88 km². A densidade demográfica atual é de 2.034,93 habitantes por km², embora, segundo dados do Plano Diretor municipal (PMG, 2006), a população fixa distribua-se de maneira desigual, estando 51% concentrada no Distrito de Vicente de Carvalho (o mais populoso) e demais no restante do território, que se estendem para áreas de risco, como morros com declividade acentuada, e para áreas de preservação permanente, como manguezais.
Tabela 12. População do Guarujá segundo situação da unidade domiciliar ao longo das últimas décadas.
|
| 1980 | 1991 | 2000 | 2010 |
| População | 151.120 | 210.207 | 265.155 | 290.752 |
| Densidade (hab/km²) | 1.057,67 | 1.471,21 | 1.855,78 | 2.034,93 |
Fonte: IBGE (2010a, 2000, 1991, 1980)
De acordo com as projeções do IBGE, entre 2005 e 2009, Guarujá apresentou uma queda significativa no crescimento de sua população. Efetivamente, no período mencionado, a taxa média de crescimento exponencial caiu a 0,5%, abaixo da média nacional de 1,0% e quase igual a do Estado de São Paulo, de 0,4% (Vicenssotti, 2010). Ainda segundo o autor, as dados demográficos disponíveis evidenciam os impactos dos movimentos migratórios e crescimento desordenado de Guarujá, produto dos grandes investimentos imobiliários nas décadas de 1970 e 1980 e a posterior redução e até mesmo fuga de empreendimentos, resultado do desenvolvimento de outros municípios vizinhos, como Praia Grande.
Por tratar-se de uma estância balneária, Guarujá recebe uma população flutuante que varia em torno de 1,6 milhões de pessoas, somando os períodos de baixa e alta temporada. Distribuídos entre, 1,3 milhões nos meses de novembro até início de maio (férias e inúmeros feriados), e aproximadamente 300 mil turistas no período de baixa temporada, entre junho e outubro.
A zona rural do município é praticamente insignificante e abrange apenas 9 estabelecimentos agropecuários que ocupam uma área de 42 hectares em região plana e fora dos limites da Serra do Guararu (IBGE, 2006). Segundo o censo 2010 do IBGE, apenas 56 moradores residem nessa área de características rurais.
Em relação aos aspectos educacionais, a rede escolar do Guarujá é bastante voltada para o ensino público, sendo que 89,9% dos alunos matriculados nos ensinos pré-escolar, fundamental e médio estudam em estabelecimentos de ensino municipal ou estadual (Tabela 13). Isso reflete a característica do município de possuir maior contingente populacional de baixa renda em relação ao de renda mais alta, normalmente representado por grande parte da população flutuante do município. Por fim, o Guarujá conta com três estabelecimentos privados de ensino superior: a Faculdade do Guarujá (UNIESP), a Faculdade Don Domenico e o campus Guarujá da Universidade de Ribeirão Preto (UNAERP).
Tabela 13. Estabelecimentos por Dependência Administrativa e Graus de Ensino no Guarujá em 2009.
|
| Ensino | Matrículas | ||||
| Federal | Estadual | Municipal | Particular | Total | ||
| Guarujá | Pré-escolar | - | - | 4.806 | 1.720 | 6.526 |
| Fundamental | - | 20.370 | 24.150 | 4.323 | 48.843 | |
| Médio | - | 10.729 | - | 713 | 11.442 | |
| Ensino | Docentes | |||||
| Federal | Estadual | Municipal | Particular | Total | ||
| Pré-escolar | - | - | 236 | 131 | 367 | |
| Fundamental | - | 998 | 838 | 292 | 2.128 | |
| Médio | - | 571 | - | 101 | 672 | |
Fonte: MEC/INEP, 2009 – Censo educacional 2009
Segundo dados apresentados pelo IBGE referentes aos Censos 2000 e 2010, a taxa de analfabetismo na população acima de 15 anos no Guarujá reduziu significativamente na última década, embora ainda seja superior à média registrada para todo o estado de São Paulo (Tabela 14). Desde 2010, o município vem promovendo a campanha “Guarujá Livre do Analfabetismo”, que visa consolidar o compromisso de enfrentar o analfabetismo, implantando ações de acordo com a realidade local. A Organização das Nações Unidas para a Educação, a Ciência e a Cultura (Unesco), considera que uma cidade está livre do analfabetismo quando consegue reduzir sua taxa para menos de 4%.
Tabela 14. Taxa de analfabetismo entre a população acima de 15 anos¹ no município de Guarujá, Estado de São Paulo e Brasil em 2000 e 2010.
|
| Taxa de analfabetismo (%) | ||
| ano | Guarujá | Estado de São Paulo | Brasil |
| 2000 | 8,45 | 6,64 | 13,60 |
| 2010 | 5,10 | 4,33 | 9,60 |
Fonte: IBGE, Censos 2000 e 2010a.
¹ É considerado o grupo etário de 15 anos ou mais, isto é, o analfabetismo avaliado acima do grupo etário onde, por lei, a escolaridade seria obrigatória.
Em relação à assistência médica e aos serviços de saúde, a Secretaria Municipal de Saúde do Guarujá é quem executa a gestão plena do Sistema Único de Saúde (SUS). Os serviços são prestados por diversas instituições, que vão desde a esfera municipal, estadual e a rede privada. A maior parte dos estabelecimentos de saúde pertence à administração pública, embora haja 20 unidades da rede privada (Tabela 15). A deficiência em atendimento médico é mais significativa em casos de média e alta complexidade, o quê faz com que aqueles pacientes com melhor poder aquisitivo sejam encaminhamento para hospitais de Santos ou da capital paulista.
Tabela 15. Número de estabelecimentos de saúde e de leitos para internação no município de Guarujá.
|
| públicos | privados | total |
| Número de estabelecimentos de saúde | 37 | 20 | 57 |
Fonte: IBGE (2010b)
Quando comparado com as estatísticas vitais e de saúde do estado de São Paulo, os valores registrados para o município do Guarujá apontam para a maior presença de população de baixa renda associada à precariedade da infraestrutura e dos serviços públicos, principalmente voltados para a saúde (Tabela 16). Resultado desse quadro são taxas maiores de natalidade, fecundidade e mortalidade infantil e entre jovens adultos, esse último também influenciado por violência urbana.
Tabela 16. Estatísticas vitais e saúde para o município de Guarujá.
|
| ano | Guarujá | Estado |
| Taxa de natalidade (por mil habitantes) | 2010 | 15,62 | 14,59 |
| Taxa de fecundidade geral (por mil mulheres entre 15 e 49 anos) | 2009 | 56,08 | 51,30 |
| Taxa de mortalidade infantil (por mil nascidos vivos) | 2010 | 19,17 | 11,86 |
| Taxa de mortalidade entre adultos jovens (15 e 34 anos) | 1009 | 139,20 | 123,27 |
Fonte: SEADE (2010).
Em geral, se observa uma tendência acentuada no município de exclusão e fratura social, manifestada na brecha cada vez mais ampla entre um grupo social minoritário, que se beneficia do modelo atual de desenvolvimento, e outro excluído desses benefícios (Vicenssotto, 2010).
voltar ao topo
4.3.1.3. Aspectos Socioeconômicos
O município de Guarujá reflete a dinâmica econômica de toda a região. A integração econômica entre os municípios da Baixada Santista dá-se pelo setor de serviços, estreitamente ligado aos períodos de alta temporada, cujas atividades correspondem na região a mais de 65% dos vínculos empregatícios formais. Em Guarujá, este índice corresponde a 66%, seguido de longe do comércio (24,74%), construção civil (5,24%), indústria (3,51%) e agropecuária (0,5%) (SEADE, 2010).
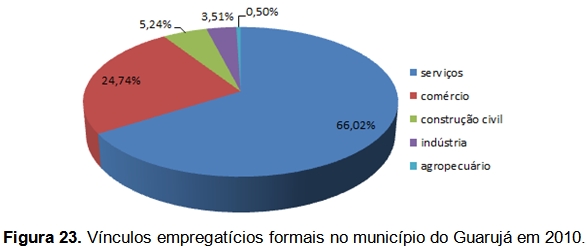
Por tratar-se de um setor da economia que não carece substancialmente de uma mão de obra extremamente qualificada, e por ser uma atividade sazonal (limitada aos períodos de alta temporada turística), os valores médios (2,04 salários mínimos) dos salários ofertados são baixos (também pela grande procura), fato este que denota comparativamente uma menor renda per capta dos habitantes residentes em Guarujá em relação à média dos demais municípios da Baixada Santista e do próprio Estado de São Paulo (SEADE, 2010).
Tabela 17. Evolução do PIB de Guarujá na última década.
|
| 2004 | 2006 | 2008 | |||
| Mil R$ | % | Mil R$ | % | Mil R$ | % | |
| Valor adicionado bruto dos serviços | 1.130.125 | 58,81 | 1.820.855 | 66,67 | 2.147.410 | 66,66 |
| Valor adicionado bruto da indústria | 617.485 | 32,13 | 596.577 | 21,84 | 691.860 | 21,47 |
| Valor adicionado bruto da agropecuária | 822 | 0,04 | 24.476 | 0,89 | 23.467 | 0,72 |
| Impostos sobre produtos líquidos de subsídios | 173.049 | 9,0 | 288.981 | 10,58 | 358.475 | 11,12 |
| PIB total | 1.921.481 |
| 2.730.889 |
| 3.221.211 |
|
| PIB per capita anual | 6.561 |
| 8.949 |
| 10.586,55 |
|
Fonte: SEADE (2010)
Por fim, após a apresentação de alguns aspectos socioeconômicos relevantes acerca do município de Guarujá, é importante concluir abordando a condição de vida geral da população que habita a região. Para isso, é usado o Índice de Desenvolvimento Humano (IDH), um indicador social criado pela ONU (Organização das Nações Unidas) há quase 20 anos de forma a permitir uma mensuração mais qualitativa do que os indicadores meramente quantitativos. Para a medição do IDH são consideradas algumas dimensões, tais como, a longevidade; a educação, mensurada pela taxa de analfabetismo de adultos (e a taxa combinada de matriculas nos níveis primário, secundário e superior); e a renda, medida pelo Produto Interno Bruto (PIB) real per capita média, tendo algumas dessas dimensões sido apresentadas e discutidas anteriormente, entre outras complementares ao entendimento do perfil socioeconômico do município. O índice varia de 0 (nenhum desenvolvimento humano) a 1 (desenvolvimento humano total). Dessa forma, o município de Guarujá apresenta o índice de 0,79, menor do que a média do restante do Estado de São Paulo, que é de 0,81, considerado de médio desenvolvimento humano (IDH entre 0,5 e 0,8) (PNUD et al, 2003). No entanto, a variação positiva do IDH de Guarujá entre 1991 e 2000 foi de 9,44%, mais que o dobro registrado para o Estado de São Paulo, que aumentou seu IDH em 4,62% na mesma década.
Tabela 18. Índice de Desenvolvimento Humano (IDH) do Estado de São Paulo e do Município de Guarujá, incluindo variação entre os anos de 1991 e 2000.
|
| Ano | Guarujá | Est. São Paulo |
| IDH | 1991 | 0,720 | 0,778 |
| 2000 | 0,788 | 0,814 | |
| Variação | 1991-2000 | 9,44% | 4,62% |
Fonte: Atlas do Desenvolvimento Humano (PNUD et al., 2003)
Os dados aqui apresentados são importantes para que se tenha uma ideia do histórico da ocupação humana no município de Guarujá, como do perfil demográfico e socioeconômico do município e da região, informações estas de suma importância para que a Unidade de Conservação abranja em seu cerne a sociedade em vários níveis, tanto sociais, culturais e econômicos.
4.3.2. Diagnóstico Local: a Serra do Guararu
A ocupação antrópica na Serra do Guararu deu-se a partir de meados do século XVII com o estabelecimento de pequenos e esparsos núcleos, pela construção do Forte de São Felipe. Posteriormente, comunidades hoje denominadas tradicionais (caiçaras) estabeleceram-se na região, implementando modos de vida e desde então diversificando o uso antrópico das terras. Com o estabelecimento de propriedades rurais em meados do século XIX, o uso das terras se fez por meio da intensificação de atividades agrícolas e extrativistas (roçados de feijão, milho, banana, extração de madeira para carvão, extração de palmito), além da pesca e coletas de crustáceos e ostras (caranguejos e ostras). Nas últimas décadas, com a pavimentação da rodovia e com o parcelamento de algumas destas fazendas, o uso da terra se fez por meio da implantação de loteamentos de alto padrão de construção e marinas.
Dessa forma, a região abrange loteamentos e marinas, parcelados em lotes de variadas dimensões, com infraestrutura viária instalada e com edificações em vários padrões de construção. Na extensão da rodovia SP-061, nos bairros denominados Cachoeirinha e Prainha Branca, o uso da terra se faz por meio de pequenos lotes plurifamiliares com baixo padrão de construção, pequenos estabelecimentos comerciais (bares, restaurantes, oficinas), além de pequenos “piers” nos lotes voltados ao canal de Bertioga. Observa-se também a presença de algumas marinas náuticas (consertos, estacionamento, comercialização, serviços) ao longo da rodovia. O mapa de uso e ocupação do solo encontra se no Anexo II – Mapas Temáticos.
voltar ao topo
4.3.2.1. Plano Diretor do Município do Guarujá
O novo Plano Diretor do Município do Guarujá instituído em 2006 (PMG, 2006), através da Lei complementar no014/06 (Lei de Zoneamento, Uso, Ocupação e Parcelamento do Solo), estabeleceu entre outras deliberações:
“O território do Município fica dividido em 2 (duas) macrozonas distintas e integradas entre si”. Conforme se demonstra na Figura 24:
a) Macrozona Urbana;
b) Macrozona de Proteção Ambiental.
A Macrozona urbana tem como objetivos controlar e direcionar o adensamento urbano, adequando-o à infraestrutura disponível; garantir a utilização dos imóveis não edificados, subutilizados e não utilizados; possibilitar a instalação de uso múltiplo no território do Município, desde que atendidos os requisitos de instalação definidos nesta Lei Complementar, na Lei 1.259/75 – Código de Edificações e Instalações –, na Lei Complementar 44/98 – Código de Posturas – e nas normas que as sucederem.
A Macrozona de Proteção Ambiental tem como objetivos: garantir a proteção dos recursos naturais e da paisagem do Município; recuperar as áreas ambientalmente degradadas e promover a regularização urbanística e fundiária dos assentamentos nelas existentes; contribuir com o desenvolvimento econômico sustentável; servir de banco de terras para compensações ambientais em processos de licenciamento de empreendimentos no Município.
Foram estabelecidas Zonas Especiais que compreendem as áreas do território que exigem tratamento especial na definição de parâmetros reguladores de uso e ocupação do solo, sobrepondo-se ao zoneamento e sendo classificadas em:
(ZEIS) Zonas Especiais de Interesse Social;
(ZEIP) Zonas Especiais de Interesse Público;
(ZEIT) Zonas Especiais de Interesse Turístico;
(ZEIPAT) Zonas Especiais de Proteção do Patrimônio;
(ZEIM) Zonas Especiais de Interesse Militar;
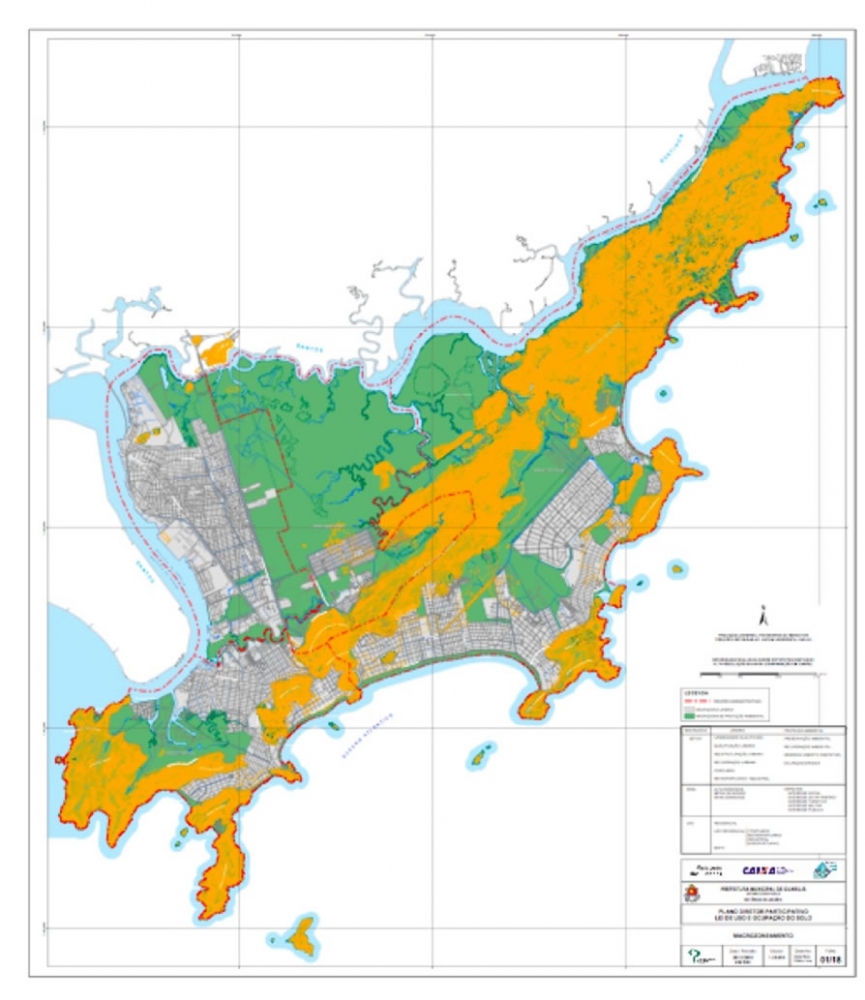
Figura 24. Macrozoneamento do município de Guarujá. Plano Diretor Participativo.
Fonte: Prefeitura municipal de Guarujá.
Dentro da Política de Proteção do Meio Ambiente foi proposto o estabelecimento do zoneamento ambiental compatível com as diretrizes para a ocupação do solo e a conservação dos recursos naturais e da paisagem.
Dentro da Política de Regularização Fundiária foi proposto dar prioridade às áreas de Zonas Especiais de Interesse Social – ZEIS e as comunidades tradicionais caiçaras; As áreas irregulares ocupadas por população de média e alta renda poderão sofrer processos de regularização jurídica mediante contrapartida em favor da Cidade, de acordo com a lei específica.
A região da Serra do Guararu encontra-se inserida na “Macrozona de Proteção Ambiental”, sendo os objetivos centrais do Plano Diretor relativos a esta porção territorial, a garantia da proteção dos recursos naturais e da paisagem, a recuperação de áreas ambientalmente degradadas, a promoção e regularização urbanística e fundiária, contribuição ao desenvolvimento econômico sustentável.
voltar ao topo
4.3.2.2. Unidades de Conservação e o tombamento da Serra do Guararu
Os remanescentes da Mata Atlântica, tanto por sua relevância biológica, quanto pelo fornecimento de inúmeros serviços ambientais voltados para usufruto da população (ex. fornecimento de água, tamponamento do clima, conservação de solos etc.), precisam de instrumentos legais e do estabelecimento de estratégias para uso sustentável e conservação. Dentre essas estratégias, o estabelecimento de corredores ecológicos, e outras formas de conexão para ligar as diversas áreas de conservação, é adequado para minimizar perdas de espécies e de variabilidade genética (as quais estão associadas com a fragmentação e isolamento dos remanescentes). Uma vez que a Mata Atlântica se encontra muito reduzida e ainda sofre grande pressão antrópica, é importante que se estabeleça uma rede interligada e coesa de áreas protegidas, englobando o maior número possível de remanescentes naturais capazes de conservar a biodiversidade e/ou fornecer serviços ambientais relevantes, para garantir a manutenção de fluxos gênicos e ecológicos através de todo o ecossistema.
A Área tombada da Serra do Guararu, por sua posição geográfica (NE da ilha de Santo Amaro) não possui uma conectividade direta (limite físico, sobreposição) com outras unidades do sistema de proteção ambiental da Mata Atlântica. No entanto, seu tamanho, localização e grau de preservação, a qualificam como um remanescente importante, num contexto regional, fazendo parte de todo um complexo de áreas protegidas do litoral paulista, que ainda abrange complexos estuarinos e unidades de conservação estaduais e municipais de várias categorias. Dentre essas destaca-se o Parque Estadual da Serra do Mar ao norte, o Parque Estadual Xixová-Japuí (em Praia Grande, a oeste), o recém criado Parque Estadual da Restinga de Bertioga a norte, e as Áreas Naturais Tombadas do Morro do Botelho e do Morro do Monduba (em Guarujá, extremo sudoeste da ilha de Santo Amaro) (Figura 25).
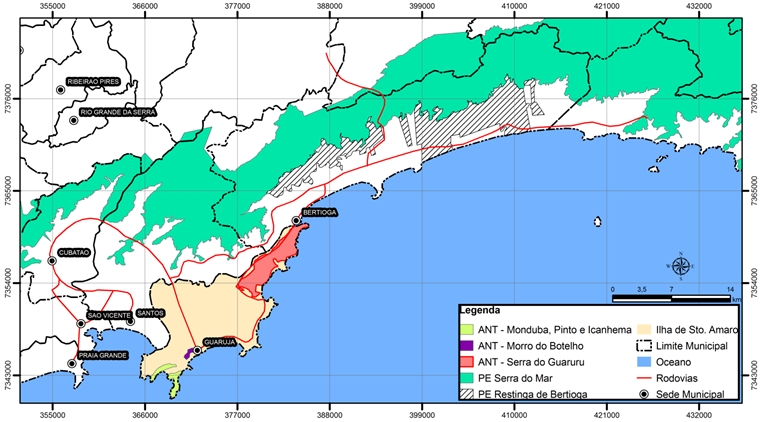
Figura 25. Mapa de localização da Serra do Guararu e unidades de conservação da região.
Embora não ocupe uma posição central no referido complexo, a Serra do Guararu e adjacências representam uma das poucas áreas significativas da Baixada Santista (e talvez de todo o litoral paulista) onde a continuidade do gradiente de ecossistemas naturais, que inclui oceano, estuários e florestas costeiras, se manteve livre de um processo de antropização mais severo, desencadeado pela urbanização. Apesar da ocupação histórica da maioria das praias, e da retirada de parte considerável das florestas da planície costeira pela implantação de loteamentos, a área da serra ainda se mantém livre dos aglomerados urbanos e dos seus drásticos efeitos, que incluem: alteração, perda, compactação e impermeabilização de solo, poluição das águas fluviais e costeiras, remoção da vegetação, aumento de temperatura e diminuição generalizada de umidade, geração intensa de resíduos, entre outros. Desse modo, a Serra do Guararu é parte importante de um dos poucos corredores onde os fluxos naturais característicos da zona costeira ainda acontecem sem atravessar diretamente uma área de alteração intensa (porém, ainda sujeitos às interferências que se propagam da vizinhança via atmosfera e meio marinho).
Em 2009, foram instituídas duas RPPNs estaduais na Serra do Guararu: Marina do Conde, com 5,05 ha, e Tijucopava, com 40,63 ha, ambas geridas pelo Instituto Litoral Verde (ILV). Antes disso, em outubro de 2008, o governador do Estado de São Paulo criou, através do Decreto Estadual n.º 53.526/2008, a Área de Proteção Ambiental Marinha do Litoral Centro (APA Marinha do Litoral Centro), com a finalidade de proteger, ordenar, garantir e disciplinar o uso racional dos recursos ambientais da região, inclusive suas águas, bem como ordenar o turismo recreativo, as atividades de pesquisa e pesca e promover o desenvolvimento sustentável da região. Para uma gestão mais eficaz, a APA foi dividida em três setores, sendo que um deles, o Setor Guaíbe, abrange o litoral dos Municípios de Bertioga e Guarujá. Além disso, a APA abrange também trechos de manguezais, como os localizados junto ao Canal de Bertioga. Embora sua delimitação se restrinja em sua maior parte à porção marinho-costeira do litoral centro paulista, algumas porções terrestres foram inseridas na APA, consideradas áreas de manejo especial para a proteção da biodiversidade, o combate a atividades predatórias, o controle da poluição e a sustentação da produtividade pesqueira. Uma dessas áreas é a Ponta da Armação, que abrange o extremo nordeste da Serra do Guararu, onde está localizada a vila da Prainha Branca (ver mapa de unidades de conservação da Serra do Guararu do Anexo II – Mapas Temáticos). Através de parceria entre a Fundação SOS Mata Atlântica e a gestão da APA Marinha Litoral Centro, e com recursos de compensação ambiental da Petrobras, tem sido realizados diagnósticos socioambiental, topográfico e fundiário, inicialmente na área de manejo especial da APA. Um dos objetivos é propor a criação de uma Reserva de Desenvolvimento Sustentável na região da Prainha Branca, ainda em fase de consultas públicas.
voltar ao topo
4.3.2.3. Ocupação humana: Loteamentos e marinas
Esta região da Serra do Guararu é caracterizada pela presença de condomínios de alto padrão localizados em um continuum remanescente de Mata Atlântica com certo grau de preservação. Existem outras grandes áreas particulares ainda não ocupadas. São quatro (04) os loteamentos de grande porte da região: Tijucopava, Taguaíba, Iporanga e São Pedro.
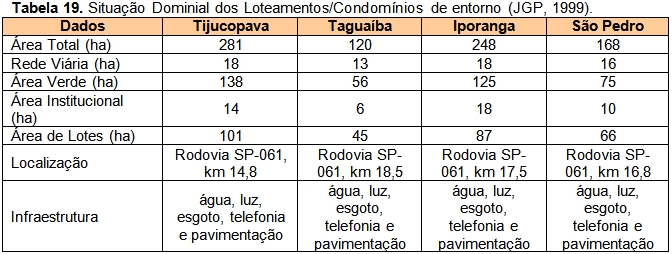
Além destes, há outros empreendimentos de menor porte instalados na Serra do Guararu ao longo da Rodovia SP-061, acompanhando o Canal de Bertioga. Dentre esses, dois possuem residências particulares cujo uso principal é o de veraneio:
• Condomínio Marina Del Rey
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, km 15,5.
Descrição: residencial particular utilizado para veraneio, com marina para garageamento de embarcações.
Infraestrutura: água, luz, esgoto, telefonia e pavimentação.
• Condomínio Marina Guarujá
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, km 10.
Descrição: residencial particular utilizado para veraneio, com marina para garageamento de embarcações.
Infraestrutura: água, luz, esgoto, telefonia e pavimentação.
Além dos residenciais náuticos supramencionados, existem marinas voltadas para o garageamento de embarcações particulares, em geral pertencentes aos proprietários das casas localizadas nos condomínios de alto padrão da Serra do Guararu.
• Marina Porto do Sol
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 21,5.
Infraestrutura: Garagem Náutica
• Marinas Nacionais
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 20,5.
Infraestrutura: Garagem Náutica.
• Marina Vindumar
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 20.
Infraestrutura: Garagem Náutica
• Marina Tropical
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 15,5.
Infraestrutura: Garagem Náutica
• Marina Tchabum
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 15.
Infraestrutura: Garagem Náutica
• Marina Píer XV
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 15.
Infraestrutura: Garagem Náutica
Existem também pequenas náuticas, com embarcações de menor porte alugadas para turistas para a prática da pesca esportiva e lazer.
• Hilda
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 19,5.
Infraestrutura: Aluguel de barcos
• Dom João
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 19,5.
Infraestrutura: Aluguel de barcos
• Chinen
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 18.
Infraestrutura: Aluguel de barcos
• Daruma
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 14.
Infraestrutura: Aluguel de barcos
• Estaleiro do Tapioca
Localização: Estrada Guarujá-Bertioga, Rod. SP-061, Km 17,5.
Infraestrutura: Construção, manutenção e reparo de barcos de pesca e de passeio.
Além das marinas e náuticas ao longo da Rodovia SP-061, que se estende entre o Canal de Bertioga e a Serra do Guararu, existem dezenas de residências unifamiliares pertencentes em geral ao bairro Cachoeirinha, além de bares e restaurantes. No km 14,5 dessa rodovia está a entrada do Centro de Estudos do Meio Ambiente (CEMA), propriedade particular e administrada pelo Instituto Litoral Verde. O local possui infraestrutura para o ecoturismo, com quatro trilhas ecológicas, rapel, tirolesa e slackline. O espaço conta também com salas para palestras, destinadas a escolas e universidades, tem ainda uma sala com exposição permanente e venda de artesanato local.
A seguir são caracterizados os quatro loteamentos de alto padrão apresentados anteriormente:
• Loteamento Tijucopava
O loteamento possui um total de 250 lotes, sendo que desses apenas 59 com residências e outros 6 com obras. Dessas 59 residências, apenas uma é habitada pelo proprietário; o restante é utilizado para veraneio. No entanto, muitos caseiros e suas famílias moram nessas residências, totalizando um número aproximado de 120 pessoas. Durante a temporada, principalmente no carnaval e reveillon, o número de pessoas que circulam pelo loteamento em um dia pode atingir até 1.500.
Não existe uma estrutura de lazer para os proprietários e veranistas, embora exista um projeto aprovado para a construção de duas quadras, uma de tênis e uma poliesportiva. Além disso, existe um campo de futebol, utilizado normalmente pelos caseiros e empregados.
Os serviços no loteamento resumem-se ao fornecimento de cadeira de praia para os veranistas, além de transporte interno (van) e segurança (39 profissionais). Não há marina no local, por isso os proprietários que possuem embarcação utilizam os serviços de garageamento das marinas localizadas no Canal de Bertioga, ao longo da Rodovia SP-061.
A energia elétrica é oferecida pela empresa Elektro. Já a água é captada das nascentes localizadas no próprio loteamento e é direcionada para 2 caixas de água (400.000L cada uma), que por gravidade abastece as residências. Todo o esgoto das residências é tratado em uma estação de tratamento (ETE) e depois lançado na costeira entre Tijucopava e Perequê. O lixo é recolhido diariamente pelos funcionários da manutenção e depois são colocados na estrada para a coleta oferecida pelo município. Não há coleta seletiva.
Existe uma associações de moradores denominada Sociedade de Amigos do Sítio Tijucopava (SASTI), que gerencia o Loteamento.
• Loteamento Taguaíba
O loteamento possui um total de 215 lotes, sendo 36 lotes com residências, 9 com casas em construção e 170 sem ocupação. Nenhuma residência é habitada pelo proprietário, utilizadas apenas para veraneio. No entanto, muitos caseiros e suas famílias moram nessas residências, totalizando um número aproximado de 72 pessoas. Durante a temporada, principalmente no carnaval e reveillon, o número de pessoas que circulam pelo loteamento em um dia pode atingir até 800. Durante fins de semana próximos da temporada chegam a circular no local cerca de 350 pessoas.
A estrutura de lazer é bastante restrita, limitando-se a uma quadra de tênis. Não existe comércio no local e os serviços abrangem apenas transporte interno (kombe) e segurança. Não há marina no local, por isso os proprietários que possuem embarcação utilizam os serviços de garageamento das marinas localizadas no Canal de Bertioga, ao longo da Rodovia SP-061.
A energia elétrica é oferecida pela empresa Elektro. Já a água é captada das nascentes localizadas no próprio loteamento e é direcionada para uma estação de tratamento de água (ETA), que abastece os reservatórios que distribuem água para as residências. Todo o esgoto das residências é tratado em uma estação de tratamento (ETE) e depois direcionado para um reservatório (sumidouro). O lixo é recolhido diariamente pelos funcionários da manutenção e depois são colocados na estrada para a coleta oferecida pelo município. Não há coleta seletiva.
Há uma associação de moradores denominada Associação dos Amigos de Taguaíba (SASIT), que gerencia o loteamento. O loteamento possui de 50 a 60 funcionários, sendo que 35 deles atuam na segurança local.
• Loteamento Iporanga
O loteamento possui um total de 551 lotes, sendo 355 com casas construídas e cerca de 40 a 50 lotes para serem licenciados. Desse total, 513 lotes são de proprietários particulares 38 pertencem à Associação dos Proprietários do Iporanga (SASIP). Apenas um proprietário reside no local, as demais residências são utilizadas para veraneio. No entanto, muitos caseiros e suas famílias moram nessas residências, totalizando um número aproximado de 400 pessoas. Durante a temporada, principalmente no carnaval e reveillon, o número de pessoas que circulam pelo loteamento em um dia pode atingir até 5.000 frequentadores.
A estrutura de lazer abrange quatro quadras de tênis, um campo de futebol, uma quadra de bocha, uma quadra poliesportiva, uma academia e uma quadra de squash. Há um clube interno para os proprietários, com piscinas e lanchonete. Não há marina no local, por isso os proprietários que possuem embarcação utilizam os serviços de garageamento das marinas localizadas no Canal de Bertioga, ao longo da Rodovia SP-061.
Os serviços diretos prestados no loteamento são:
• Administração e gerenciamento das atividades e serviços diretos e indiretos;
• Segurança patrimonial;
• Aprovação e fiscalização das obras do loteamento;
• Manutenção da drenagem das águas pluviais;
• Manutenção e instalação prediais (hidráulica, elétrica e civil);
• Tratamento de água e esgoto;
• Jardinagem nas áreas comuns;
• Serviço de cadeira de praia;
• Manutenção e produção de mudas nos viveiros e reflorestamento;
• Limpeza de praia, ruas, passarela, clubes;
• Limpeza predial de instalações comuns;
• Controle de insetos;
• Processo de compostagem vegetal;
• Coleta de lixo doméstico (coleta seletiva);
• Ambulatório médico
• Transporte interno com ônibus circular;
Os serviços indiretos são:
• Consultorias técnicas
• Contabilidade;
• Saúde ocupacional;
• Pavimentação e construção civil de maior escala;
• Coleta de lixo vegetal;
• Analise de qualidade das águas;
• Contratação de festas/ entretenimento (festa ano novo, festa junina, monitoria de crianças, academia e massagens);
• Processos jurídicos;
• Limpeza de fossas;
• Transporte dos funcionários.
A administração do loteamento proíbe a circulação de ônibus, lotações, utilitários, ou qualquer outro veículo de transporte coletivo, salvo os de serviço. Em decreto estabelecido como município, a administração mantém vagas de estacionamento para veranistas que não possuem propriedade no local, sendo responsável pelos meios necessários para a efetivação da restrição de circulação de acordo com o limite máximo de vagas de automóveis.
A SASIP possui uma frota de três caminhões, três utilitários, um carro administrativo, onze motos, dois micro-ônibus e uma van para os funcionários dos associados. Possui também quatro geradores estacionários e um gerador móvel para a realização das atividades de serviços principais e outras de menor escala.
São dez os postos de segurança. Para a fiscalização, o Loteamento informatizou a portaria e adquiriu seis bicicletas que auxiliam nas rondas. A comunicação via rádio também foi melhorada, são agora 22 rádios HTs com cinco centrais fixas nos postos e uma central móvel na viatura. O sistema de monitoramento possui doze câmeras instaladas em pontos estratégicos e prevê a instalação de outras dez. Existem também dois botes motorizados que fazem a fiscalização das praias juntamente com os bombeiros no final de semana. As praias contam com guaritas dotadas de iluminadores noturnos. São 80 funcionários formados em escolas certificadas pela Polícia Federal que atuam na segurança do local. Com relação às áreas verdes, três seguranças da SASIP costumam fazer rondas diárias nestas regiões.
A gestão do Loteamento Iporanga, incluindo suas áreas verdes, foi transferida à SASIP – Associação dos Proprietários do Iporanga - pela Prefeitura Municipal do Guarujá, através da Lei Municipal nº 051/97. A SASIP implantou no Loteamento um Sistema de Gestão Ambiental (SGA) com base na norma ISO 14001. Dentro do âmbito do SGA e de acordo com a sua política ambiental, o manejo adequado da Área de Preservação Ecológica e demais áreas verdes do loteamento é ponto fundamental.
A energia elétrica é oferecida pela empresa Elektro. O Loteamento possui uma barragem (com outorga) que capta água no rio Iporanga até duas estações de tratamento de água (ETAs), onde são feitos os processos de floculação, filtragem e cloração (em média 12.000 m³/mês). A água tratada é então bombeada para reservatórios em pontos elevados, distribuindo por gravidade para todo o loteamento.
O esgoto é captado por uma rede coletora (95% do loteamento) e levado para duas estações de tratamento de esgoto (ETEs), que tratam pelo processo biológico de lodo ativado aeróbico, sendo que o efluente final é lançado ao mar em um emissário costeiro (em média 3.000 m³/mês). São feitas análises mensais de todas as águas e efluentes para a verificação da qualidade e enquadramento legal. Foi concluída recentemente a ampliação e melhoria da ETE 1 que atende a toda a vertente oceânica do Loteamento, uma vez que a ETE2 será desativada. O processo de tratamento do efluente é centralizado em um filtro aerado submerso. Além disso, foi implantada uma ETE compacta para tratamento dos efluentes da vertente do canal (administração, clube, igreja, ambulatório). O sistema de gestão ambiental prevê o monitoramento dos efluentes, bem como acompanhamento da qualidade da água das praias.
No Loteamento existe um programa de coleta seletiva de resíduos sólidos diferenciado em lixo comum, lixo reciclável e lixo vegetal (resíduos de podas). A coleta seletiva dos resíduos domésticos é feita diariamente, preferencialmente no período matutino. Durante a temporada, o lixo é coletado duas vezes ao dia ou mais, se necessário. Para gerenciar a questão de resíduos do loteamento foi criado o programa “Sucata Limpa, Destino Certo”. O lixo reciclável, já identificado por sacos de cor laranja, é enviado para o Centro de Reciclagem da Serra do Guararu, localizado em um terreno na Rodovia SP-61, para então ser destinado às indústrias de reciclagem. Neste centro trabalha na separação do lixo, um grupo de pessoas da comunidade local, que se beneficia da renda gerada pela reciclagem. O lixo orgânico e os dejetos são armazenados em um barracão de transbordo aonde a prefeitura faz a coleta seletiva. O lixo vegetal (podas de jardim e sacaria de folhagem) é coletado diariamente e destinado ao Centro de Compostagem da SASIP, onde ocorre a triagem e o processamento do mesmo. Os montes formados pela trituração do material ficam aproximadamente três meses para virar composto.
A SASIP desenvolveu, entre 2002 e 2005, uma parceria com a Fundação SOS Mata Atlântica no “Projeto Guararu”, que visou a conservação da Serra do Guararu através do desenvolvimento sustentável da região num modelo participativo. O projeto diagnosticou a situação geral da região e através da identificação das lideranças comunitárias, tentou solucionar os problemas socioambientais gerados ao longo de anos.
Já entre 2007 e 2008 a SASIP contratou a Ambiental Consulting para elaborar o Plano de Manejo do Loteamento, focando principalmente no manejo adequado das áreas verdes, intituladas como Área de Preservação Ecológica na Serra do Guararu (Ambiental Consulting, 2008). Para o PM foram realizados diagnósticos e mapeamentos e elaborados o zoneamento e programas de manejo, incluindo proteção e fiscalização, recuperação (viabilizada pelo viveiro de mudas nativas mantido pela SASIP), manutenção, monitoramento, pesquisa, educação ambiental e programa de desenvolvimento sustentável da comunidade do entorno.
• Loteamento São Pedro
O loteamento possui um total de 186 lotes, sendo 105 sem construções e 81 com casas construídas. Dessas, 10 pertencem a um resort ali instalado. Nenhum proprietário reside no local, por isso as residências são utilizadas apenas para veraneio. No entanto, muitos caseiros e suas famílias moram nessas residências, totalizando um número aproximado de 107 pessoas. Durante a temporada, principalmente no carnaval e reveillon, o número de pessoas que circulam pelo loteamento em um dia pode atingir até 3.000 frequentadores.
Há cerca de 95 vagas no estacionamento da praia para visitas de fora, principalmente para os fins de semana e alta temporada. Há 64 funcionários da Associação que trabalham no loteamento, mas que não são residentes.
A estrutura de lazer e esporte abrange duas quadras de tênis, uma bocha, uma pista de skate, uma quadra de futebol e uma piscina natural de pedra. O único comércio local é uma lanchonete na praia que só funciona durante o dia nos finais de semana. Não há marina no local, por isso os proprietários que possuem embarcação utilizam os serviços de garageamento das marinas localizadas no Canal de Bertioga, ao longo da Rodovia SP-061.
Os serviços prestados pelo Loteamento são de transporte interno, segurança e coleta de lixo. Há uma van terceirizada que faz o transporte dos funcionários do loteamento até suas casas e há outra van que faz o transporte dos filhos dos caseiros residentes até o ponto de ônibus na estrada.
A energia elétrica é oferecida pela empresa Elektro. O abastecimento de água ocorre através de um sistema de filtragem a partir de uma nascente existente dentro do loteamento. Da nascente, a água é direcionada para um reservatório e depois vai para quatro filtros (20 mil L/h cada), e então é finalmente distribuída para as casas. Algumas casas em locais mais altos possuem sistema de bombeamento. Nas casas localizadas na planície, próxima à praia, o esgoto é direcionado para a ETE do Iporanga, enquanto que nas casas localizadas nos morros existem fossas sépticas. Existem duas coletas de lixo orgânico e de reciclados feitas de segunda, quarta, sexta, sábado e domingo por um transporte particular do loteamento. Os loteamentos de São Pedro e Iporanga trabalham juntos levando os reciclados para o Centro de Reciclagem, onde algumas pessoas que moram nas estradas fazem o trabalho de triagem e uma empresa compra os materiais separados. Os lixos orgânicos tanto do loteamento de São Pedro e Iporanga são recolhidos e levados para uma jazida, onde são despejados em containeres e que, aos cuidados da prefeitura, são levados para um lixão.
Há a Associação dos Amigos de São Pedro, que gerencia o loteamento. Além disso, o loteamento possui parceria com a Gremar para trabalhar a reabilitação de animais marinhos e está sendo feita uma tentativa de parceria com o Campus Guarujá da Universidade de Ribeirão Preto (UNAERP), para estimular a pesquisa no local, e com a UIPA, para controle de animais domésticos.
4.3.2.3. Ocupação humana: bairros e comunidades locais
• Praia do Perequê
A Praia do Perequê é o único bairro urbanizado da Serra do Guararu. Sua ocupação iniciou com a instalação de comunidades de pescadores e migrantes que ali se fixaram. Com o crescimento populacional e desenvolvimento do turismo no município, a especulação imobiliária reconfigurou o espaço no Perequê, com a instalação de comércios próximos à praia, enquanto os moradores mais antigos, normalmente dependentes da pesca e de renda mais baixa, acabaram sendo “empurrados” para as áreas de mangue e encostas de morros que formam a Serra do Guararu.
De acordo com Carvalho (2010), a ocupação mais significativa na praia do Perequê iniciou a partir do século XVIII com a construção da Capela dos Escravos. No lugar do condomínio Morana, havia uma fazenda que pertenceu a Bidu Saião, com uma senzala onde ficavam muitos escravos. Essas ruínas foram destruídas e deram lugar a novas habitações e comércio. Atualmente, o Perequê tem uma população estimada em cerca de 10.000 habitantes, com remanescentes de vilas de pescadores em alguns trechos com infraestrutura e saneamento mais precários que o restante.
Os poucos trabalhos acadêmicos realizados na região focam a comunidade de pescadores, que atualmente corresponde a uma minoria da população residente do Perequê. Os estudos abordam majoritariamente a pesca do camarão sete-barbas, principal atividade praticada pelos pescadores locais e responsável pela maior parte da renda obtida por estes (Souza ETAs, 2011; 2009a; 2009b; 2009c).
Embora tenha a origem de sua ocupação decorrente da pesca, atualmente a atividade é pouco frequente, e apenas uma minoria dos moradores do bairro ainda se autodenomina pescadores. Dos cerca de 10.000 moradores do Perequê, apenas 400, aproximadamente, são cadastrados na colônia de pesca local. Destes, 300 são pescadores homens e 100 são mulheres cadastradas como profissionais envolvidas com a pesca, uma vez que, mesmo que não pesquem embarcadas, são responsáveis por atividades relacionadas à pesca, como a limpeza dos camarões. Dessas famílias de pescadores, apenas uma menor parte são descendentes dos primeiros caiçaras que ocuparam o local. O restante é formado por pescadores que vieram de Santa Catarina e por migrantes vindos do Nordeste, principalmente de Alagoas, que só quando chegaram ao Perequê ingressaram na atividade da pesca por ser o forte da economia local na época.
Atualmente o bairro conta com 4 escolas públicas, sendo uma de dependência administrativa estadual e três municipais. A E.E Pastor Jaconias Leite da Silva oferece do 6º ao 9º ano do ensino fundamental, assim como todo o ensino médio e educação de jovens e adultos (EJA). A E.M. Benedicta Blac Gonzalez oferece o ensino fundamental completo, além de manter uma creche. A E.M. Mário Cerqueira Leite Filho oferece da 1ª a 4ª do ensino fundamental e EJA, enquanto a E.M. Maria Eunice da Cruz é voltada apenas à educação infantil (crianças de 4 a 6 anos).
Só existe um estabelecimento de saúde, o Pronto Socorro localizado na Av. Vila Nova. Além de atender os casos de primeiros socorros, também faz a triagem e encaminha pacientes para hospitais no centro do Guarujá ou Vivente de Carvalho, dependendo do caso e da gravidade. No Condomínio Morana, próximo do Perequê, há uma USAFA (Unidade de Saúde da Família), que também atende os moradores do bairro. Além disso, existem agentes da saúde que visitam as residências periodicamente, em sua maioria moradora do próprio Perequê.
O abastecimento de água é feito pela Sabesp. Nas residências irregulares localizadas nas encostas dos morros, a água é captada de cachoeiras e nascentes. Não há tratamento de esgoto doméstico, sendo que parte é lançado in natura no Rio do Peixe e a outra em um canal perto da Ponta da Praia (Fundão), na parte conhecida como Vila Nova, através de tubulação instalada pelo próprio poder municipal. O lixo é coletado regularmente nas casas por empresa concessionada.
Existem linhas de ônibus para a Balsa de Bertioga e para bairros centrais do Guarujá e distrito de Vicente de Carvalho. No Fundão do Perequê há um ponto final de ônibus, de onde partem algumas linhas e é possível fazer baldeação para outras.
O atendimento policial é precário, uma vez que não há mais posto policial no bairro, apenas rondas policiais esporádicas. O posto mais próximo localiza-se no bairro de Pernambuco. Ainda assim, alguns moradores relataram que o bairro não é muito violento, embora haja crescente consumo e venda de drogas.
Há uma parte da população que se volta para a pesca ou atividades associadas. Geralmente, os pescadores são adultos e os jovens não continuam mais o serviço de pesca realizado pelos pais. Poucos dos caiçaras estão trabalhando com a pesca, sendo predominantes os migrantes do sul e do nordeste nessa atividade. A maior parte desses pescadores veio para o Perequê porque já tinham um conterrâneo ou conhecido na região. Atualmente, o camarão encontra-se bem mais escasso. Numa saída de barco, costuma-se pescar cerca de 50 a 100kg de camarão por dia, enquanto que antigamente pescava-se cerca de 150kg. Um dos motivos que contribuiu para essa redução foi a prática da pesca industrial, que reduziu em grande escala o estoque disponível para a pesca artesanal. O período de defeso vai de março a maio. A renda média do pescador é de cerca de três a quatro salários mínimos. No entanto, no defeso recebem apenas um salário. Muitos também trabalham em marinas, condomínios e construção civil, com manutenção, segurança, jardinagem, como caseiros ou diaristas. A maioria da população trabalha na cidade.
Não há indústria na região, apenas rede de serviços e comércios (restaurantes, bancas de jornal, padarias, bares e peixarias). As peixarias vendem principalmente o camarão-sete-barbas pescado ali, sendo que algumas também revendem peixe comprado na região próxima à balsa para Santos. Apenas 4 pescadores do Perequê ainda pescam peixe, os demais são todos especializados na captura do camarão.
Com a criação da APA Marinha, integrantes da colônia de pesca começaram a fazer parte do conselho gestor da UC. Para reduzir os impactos da pesca industrial sobre a artesanal, esse conselho conseguiu propor um zoneamento de áreas de pesca na região, onde se determinou, de acordo com a profundidade do mar, as áreas permitidas para cada tipo de pesca.
Dos 230 barcos existentes na região, 10 são alugados para os turistas para a prática de pesca esportiva, 4 são utilizados para a pesca de peixe e o restante para a captura do camarão.
A ocupação inicial do Perequê se deu na região da foz do Rio do Peixe, se estendendo pela praia até a sua ponta, sentido Tijucopava, onde os moradores locais chamam de Fundão. Com o crescimento populacional das últimas décadas, a ocupação foi se interiorizando através da planície costeira em direção aos morros da Serra do Guararu, originando a porção do Perequê denominada Vila Nova, que atualmente abriga a maior parte da população local e apresenta os piores índices de infraestrutura e saneamento.
São duas as associações comunitárias de moradores. Uma é a Sociedade Vila Nova Perequê, e a outra a Associação dos Amigos do Perequê (SAPE). Existe também a Pastoral da Terra, ligada a igreja católica.
A principal festividade no Perequê é a Festa de São Pedro, santo padroeiro dos pescadores, realizada todo dia 29 de junho, com missa e procissão de barcos. Há uma premiação para os barcos enfeitados e ocorre quermesse do dia 15 de junho a 30 de junho.
• Comunidade Cachoeirinha
a) Histórico
A Comunidade Cachoeirinha é um bairro localizado ao longo da Rodovia Guarujá-Bertioga (SP– 61) entre os km 11,5 e 22, com concentração de casas entre os km 12 e 14,5. A área tem problemas dominiais desde o século XIX e abrigava, em 2002, menos de 250 famílias, que em sua maioria vivem no local há décadas. O bairro está localizado em área tombada e reconhecida pelo CONDEPHAAT em 1992 (Processo: 26632/88,?Tombamento: Resolução nº 48 de 18/12/92). O bairro tem este nome devido à profusão de cachoeiras existentes em toda a vertente da serra do Guararu (SOS Mata Atlântica, 2002a).
De acordo com relatos obtidos em campo, a região onde hoje se encontra o bairro Cachoeirinha começou a ser ocupada a partir de 1876. Uma das primeiras famílias a chegar ao local foi a Oliveira, quando o Sr. Gabriel de Oliveira adquiriu ali uma Fazenda de 540 alqueires (aproximadamente 1300 ha), e passou a cultivar cana e cacau e a produzir cachaça no engenho que construiu. Por volta de 1926 e 1948, a Fazenda atraiu novas famílias que ali se estabeleceram para trabalhar nas plantações e acabaram permanecendo como permissionárias da família Oliveira. Grande parte dos moradores da região, em especial aqueles concentrados entre os km 12 e 13, próximos das ruínas do antigo engenho de açúcar, são descendentes da família Oliveira e das permissionárias que ali se instalaram até a metade do século XX.
Outra família estabelecida na região, a família Santos, é uma das mais numerosas e concentra-se nas proximidades do km 14, sendo também um exemplo de permissionária da família Oliveira. Já a família Machado chegou ao local em 1932 e adquiriu o sítio Monte Alegre, área onde atualmente está o Loteamento Sítio São Pedro.
Muitas dessas famílias que se estabeleceram no Cachoeirinha eram originárias das regiões de Picinguaba e Paraty, trecho entre o extremo norte do litoral de São Paulo e o litoral sul do Rio de Janeiro. As primeiras pessoas que chegaram na região fizeram suas casas de sapê e, ao redor destas, as gerações posteriores foram erguendo as suas casas de alvenaria.
Relatos de membros da comunidade enfocam que no início do século XX a economia local girava em torno da exploração e comercialização de banana, carvão e palmito, entreposto da pesca de sardinhas, e pesca em geral. Na década de 1960 o caminho por terra que ligava a então comunidade ao resto do município transformou-se na Rodovia SP-61 (Guarujá-Bertioga) e juntamente com esta, vieram outras transformações. A década de 1980 por sua vez, marcou o início da instalação dos loteamentos de alto padrão de construção (Iporanga, São Pedro, Tijucopava) e das marinas e náuticas.
b) Estrutura social e ocupação do espaço
Segundo os levantamentos da SOS Mata Atlântica (2002a), a maioria dos entrevistados (62%) mora há mais de 20 anos na região (Figura 55).
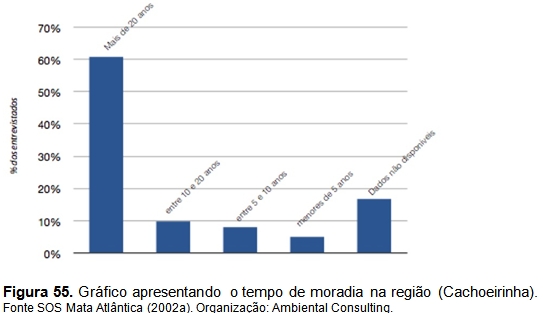
Das 194 moradias contabilizadas no levantamento, totalizou-se 698 moradores, o que corresponde a uma média de 3,6 pessoas/casa, sendo 66% adultos (acima de 15 anos de idade) e 34% crianças (idade inferior a 15 anos) (Figura 56).
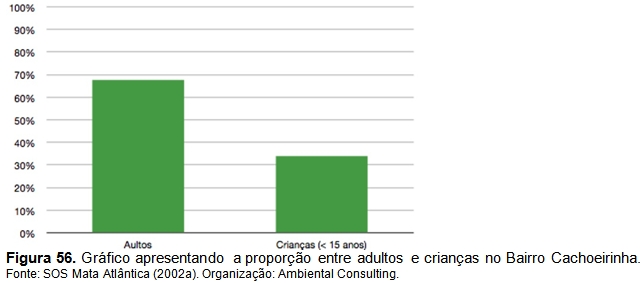
A forma de ocupação local se deu pelo aumento das famílias já existentes ou pela “camaradagem” (permissão a outrem em ocupar porção dos terrenos), onde as famílias mais antigas “consentiam” que outras famílias se instalassem no local. Aparentemente a ocupação do local por famílias de outras localidades não era tão comum como nas últimas duas décadas. Sendo que, nestas últimas décadas, o padrão de ocupação fugiu do controle das famílias mais antigas.
Segundo os levantamentos da SOS Mata Atlântica (2002), a maior parte dos terrenos das casas entrevistadas (42%) está localizada no km 14 da Rodovia SP-61, como apresentado no histograma que segue (Figura 57);
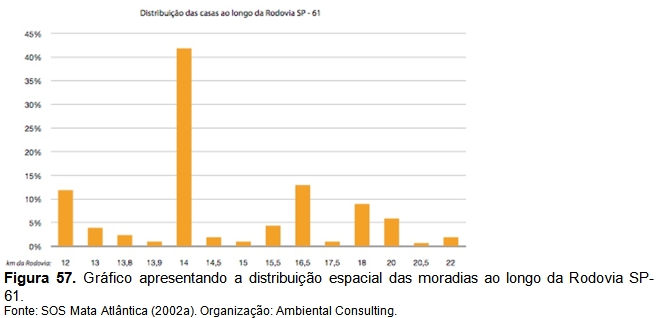
De acordo com os levantamentos realizados, cerca de 82% das residências localizam-se na área correspondente às vertentes da serra do Guararu (sopé, meia encosta), enquanto 18% estão localizadas às margens do canal de Bertioga, em área predominantemente de manguezal, como mostra o gráfico da Figura 58.
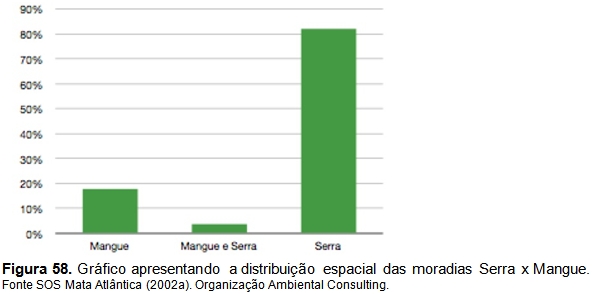
Os levantamentos realizados em 2002 apontaram que as moradias construídas na serra predominam entre os km 12 e 14,5 e adiante entre os km 18 e 22. Já aquelas construídas às margens do canal, em área de manguezal, situam-se predominantemente entre o km 15 e 17,5. Tal distribuição se deve ao fato de que em vários trechos o espaço entre o traçado da estrada e o limite do manguezal não permite a ocupação sem que se aterre o mesmo. Com relação às casas construídas na serra, apenas aquelas localizadas nas proximidades dos km 12, 21 e 22 estão em terrenos com baixa declividade. A alta declividade dos terrenos no restante da estrada pode ter sido um fator limitante para uma ocupação mais intensa.
De acordo com os dados obtidos pela SOS mata Atlântica, considerando os entrevistados que responderam à questão sobre a “posse das terras/terrenos”, do bairro Cachoeirinha (Tabela 20), as informações prestadas apontaram que 76% dos terrenos/lotes, pertencem a variadas famílias (pessoas físicas) sendo deste total, 36% pertencentes às famílias Oliveira e Santos. Os terrenos pertencentes a Pessoas Jurídicas correspondem a 24% do total, sendo 9% atribuídos a Marinas e Náuticas e 15% restantes pertencerem à empresa BCN (Banco de Crédito Nacional).
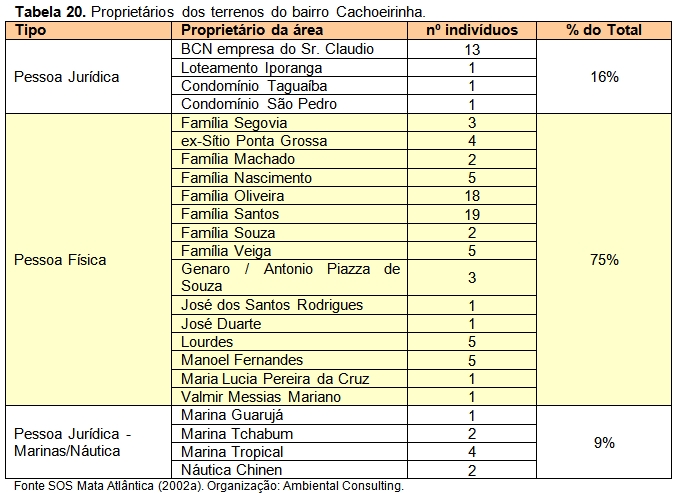
Ainda em relação à organização social dos moradores, os mesmos são associados à SOMAC (Associação dos Moradores e Amigos do Cachoeira). Apenas uma minoria, que ainda atua na pesca, é associada à Associação dos Pescadores.
c) Infraestrutura e habitação
O nível de escolaridade é baixo entre os moradores da região, principalmente entre a parcela de adultos com mais idade. As crianças do bairro estudam na única escola instalada na Rodovia, a E.E. Bom Jardim, localizada no km 17, na entrada do loteamento Iporanga, atendendo também os filhos dos caseiros que trabalham nos condomínios. As crianças, que moram ao longo da rodovia, são transportadas por um ônibus escolar gratuito.
A E.E. Bom Jardim oferece apenas o ensino fundamental de 1ª a 4ª série. Para estudar da 5a série em diante as crianças precisam se deslocar até o Perequê ou centro de Bertioga. Para elas, não há ônibus escolar gratuito, forçando as crianças a pagar por ônibus circular comum.
A antiga escola que atendia à comunidade, a E.E. Gabriel Bento de Oliveira, localizava-se no km 13,5 e foi desativada em 2004. O prédio deu então lugar à Capela Santa Bárbara. Alguns moradores se queixam dessa mudança, uma vez que a escola se afastou do local onde há maior concentração de casas.
Não há na comunidade estabelecimento de saúde, sendo que os moradores precisam se deslocar até o Pronto Socorro do Perequê ou de Bertioga. Em casos de emergência, ambulâncias disponibilizadas pela Secretaria de Saúde do Guarujá fazem o transporte do paciente até o Pronto Atendimento do Guarujá, que faz a triagem e encaminha para algum estabelecimento de saúde do município. Existem alguns agentes de saúde que visitam as famílias do bairro, mas sem a periodicidade e regularidade adequada.
Para o transporte, parte dos moradores possui carro e/ou motocicleta particulares. Existe uma linha de ônibus que liga o fim da Rodovia, na balsa para Bertioga, até a Praia do Perequê. Os passageiros com destino ao centro do Guarujá e Vicente de Carvalho precisam fazer baldeação no terminal de ônibus do Perequê, embora sem custos via cartão de integração.
A segurança local é precária, não possuindo base ou posto policial. A única segurança disponível, ainda que indireta, se dá através de rondas do pessoal de segurança particular dos condomínios da região. Ainda assim, é um bairro com pouca violência. Segundo alguns moradores, tem crescido o consumo de drogas no bairro, principalmente entre os mais jovens. Outro elemento que incomoda os moradores é a falta de lazer no bairro, que não apenas contribui para o aumento no consumo de drogas, como também acaba facilitando a ocorrência de atropelamentos na Rodovia, pois sem áreas comunitárias os moradores, principalmente jovens e crianças, reúnem-se nas margens da via para interações cotidianas. É importante ressaltar que, com a presença de bares ao longo da rodovia, também são frequentes os acidentes provocados por motoristas alcoolizados, principalmente aos finais de semana.
O fornecimento de energia elétrica é feito pela empresa Elektro. Já a água é captada de nascentes e de cursos d’água, denominados cachoeira, através de mangueiras e tubulações que abastecem as caixas d’água individuais das residências.
Não existe tratamento de esgoto no bairro, apenas algumas poucas casas possuem fossa séptica. A maioria despeja seu esgoto nos cursos d’água próximos através de encanamento improvisado ou valas expostas, que dali segue e é despejado in natura nas águas do canal de Bertioga. Existem, ainda, casas que despejam o esgoto em alguma mancha de vegetação, servindo como sumidouro. Já o lixo é coletado três vezes por semana por empresa contratada pelo Município de Guarujá.
O bairro conta com alguns estabelecimentos comerciais, todos localizados na beira da Rodovia e voltados para os turistas que circulam pela via. São quatro bares e restaurantes (Recanto do Gato, Bar do Pedro Marcelino, Restaurante do Joca, Restaurante do Dalmo, Acqua Verde, Bar da Bica e Restaurante do Mauro). O Recanto do Gato também possui uma mercearia e um posto do correio para atender os moradores locais. Além desses, existe no local uma mercearia e uma loja de materiais de construção. Existem três igrejas, duas evangélicas e uma católica.
Os atrativos turísticos do bairro resumem-se aos restaurantes e às atividades náuticas oferecidas pelas marinas e náuticas instaladas ao longo do canal de Bertioga, incluindo a pesca esportiva.
d) Economia
Atualmente as atividades comerciais da região procuram voltar a sua infraestrutura para o atendimento do turismo. Tendo como atrativos a beleza cênica da região, estão instalados ao longo da rodovia diversos restaurantes, bares, marinas, além da locação de barcos para passeios turísticos e pesca esportiva.
A tabela a seguir apresenta os ramos de atividade e os tipos de ocupações declaradas durante as entrevistas realizadas na comunidade Cachoeirinha (Tabela 21).
Uma análise prévia desta tabela indica um predomínio de ocupações ligadas ao setor de serviços (refletindo o perfil do próprio município), mais de 50% da totalidade. Destacando-se atividades tradicionais como pesca e coleta de mariscos, que correspondem a 11%, além daqueles que se declararam funcionários dos condomínios das proximidades, 24% do total entrevistado.
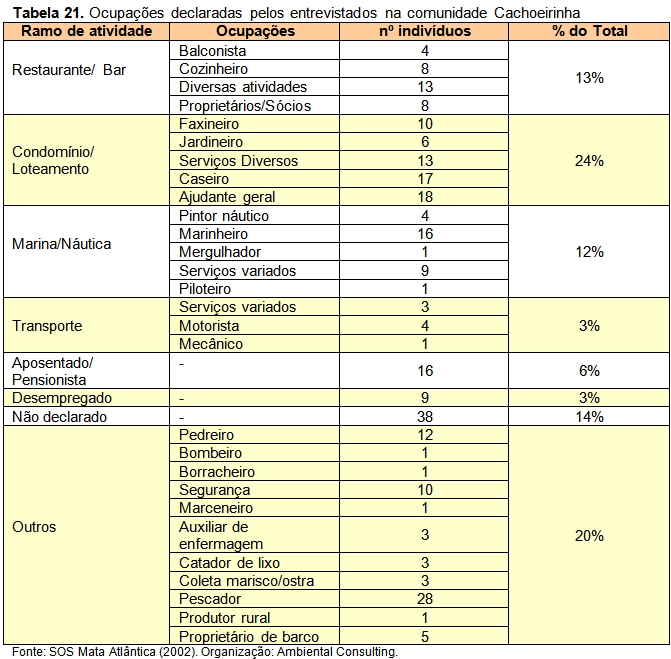
• Comunidade da Prainha Branca
A Praia Branca está situada no extremo nordeste da região denominada “Rabo do Dragão” (Serra do Guararu), na Ilha de Santo Amaro. O acesso a tal comunidade dá-se por uma trilha localizada ao lado direito do atracadouro na balsa de acesso à Bertioga (final da rodovia SP-61). Esta trilha possui aproximadamente 2km, sendo possível apenas o trânsito de pedestres.
a) Histórico
As ruínas históricas localizadas na Praia Branca refletem a história da colonização do Brasil, pois no século XVI foram edificadas a fortaleza de São Tiago (Bertioga) e na margem oposta, a fortaleza de São Luis (Ilha de Santo Amaro) para proteger a barra de Bertioga. A área onde hoje está situada a Praia Branca foi ocupada nos primórdios da colonização portuguesa por instalações de armação de baleia e a partir do século XX a região passou a ser ocupada por caiçaras, lavradores e pescadores. Além das ruínas, fornos de carvão espalhados pelos morros da região indicam a prática da produção de carvão no passado.
Um dos traços da origem caiçara do local é a distribuição das habitações, as quais acompanham a linha de costa, sempre atrás e protegidas pela vegetação de restinga. Segundo os levantamentos realizados pela Fundação SOS Mata Atlântica (2004), as famílias mais antigas ainda existentes no local datam do início do século XX, sendo representadas pelos senhores Pedro e Narciso (moradores mais antigos da comunidade). Segundo relatos, os primeiros ocupantes da Prainha vieram da Ilha do Monte de Trigo, São Sebastião, e, mais tarde, da região de Picinguaba, em Ubatuba.
b) Estrutura social e ocupação do espaço
De acordo com o Anteprojeto de Lei para o Sistema Estadual de Unidades de Conservação (SMA, 1998), a comunidade residente na Praia Branca pode ser considerada tradicional, pois, caracteriza-se como “agrupamento humano com origem, ocupação e vínculo histórico-cultural com a região por pelo menos duas gerações, com identidade cultural reconhecida pela comunidade, cuja reprodução material e sócio-cultural está diretamente relacionada com o ecossistema da região”. Da mesma maneira, o processo de tombamento da Serra do Guararu pelo CONDEPHAAT em 1992 (Processo: 26632/88,?Tombamento: Resolução nº 48 de 18/12/92) estabelece que “faz parte também deste tombamento a Vila da Prainha Branca, por abrigar elementos culturais representativos das comunidades caiçaras”.
Relatos indicam que a pelo menos um século atrás havia na região quatro moradias, pertencentes a três famílias. O crescimento da ocupação ao longo de décadas, deu-se pelo aumento do número de indivíduos destas famílias e pela ocupação de famílias de outras localidades (consentidas pelas famílias antigas). Atualmente percebe-se um considerável número de casas de veraneio e, em alguns dos antigos quintais, construções de novas moradias plurifamiliares.
A Tabela 22 procura demonstrar a progressão no número de habitantes da Praia Branca, segundo o levantamento da SOS Mata Atlântica (2004). Salienta-se que, apesar dos dados relativos a 1928 e 1942 corresponderem a número de famílias e os dos anos 1978 e 2004 corresponderem ao número de habitantes, pode-se chegar a um indicativo do crescimento da população na localidade.

Em trabalho de campo realizado em outubro de 2011, lideranças locais estimaram a população atual em cerca de 500 habitantes pertencentes a 90 famílias. São poucas as casas de veraneio, aproximadamente 10, geralmente pertencentes a pessoas de Santos e São Paulo.
A comunidade da Prainha Branca possui uma associação comunitária, denominada Sociedade Amigos da Prainha Branca (SAPB), criada em 1972 com auxílio de um missionário jesuíta canadense. O grupo tem como principais atividades as questões relacionadas à destinação do lixo, segurança pública, educação e promoção do turismo sustentável. No ano de 2002 a SAPB estabeleceu uma parceria com o Projeto Guararu (Fundação SOS Mata Atlântica e Associação dos Proprietários do Iporanga – SASIP) com o objetivo de trabalhar ações em prol da gestão socioambiental da região.
Existem algumas festividades mais tradicionais que ainda são mantidas, como a Festa da Padroeira (Nossa Senhora Imaculada da Conceição), que ocorre em 8 de dezembro. Durante oito dias que antecedem o dia da santa, há uma reza da novena em latim pela população na capela local. No dia 8 de dezembro ocorrem o leilão, o bingo e o encerramento (Ladainha) após uma procissão. Outra festividade é a Folia de Reis, realizada todo dia 6 de janeiro, quando moradores caminham de casa em casa para realizar o “reisado”, utilizando trajes específicos. Para os moradores que abrem as portas de suas casas, é feito uma reza. As festas juninas também são realizadas no local, com quadrilha, comidas típicas e bingo. Recentemente, alguns moradores criaram o Baile da Primavera, realizado em outubro, onde há barracas de comidas e desfile de fantasias. Os moradores criaram também, recentemente, a Festa da Tainha, que ocorre nos dois últimos finais de semana de julho, onde são montadas barracas de artesanato e venda de tainha na brasa. No entanto, a tainha não é pescada na região, mas comprada em localidades próximas.
Há apenas uma igreja católica no bairro, e nenhuma igreja evangélica. Por isso, a minoria evangélica se desloca para localidades próximas, como Bertioga e Cachoeirinha, para assistir a cultos.
c) Infraestrutura e Habitação
No local existem duas escolas. Uma, de dependência administrativa municipal, oferece apenas o ensino infantil, equivalente à antiga pré-escola, para crianças entre 4 e 6 anos. Em 2011 a turma contava com cerca de 20 crianças. A outra escola, de dependência administrativa estadual, oferece os quatro primeiros anos do ensino fundamental em regime “multissérie” (classe única), que conta com cerca de 20 crianças. Após o cumprimento do ensino fundamental, os alunos que pretendem continuar os estudos dirigem-se para outras localidades, especialmente em Bertioga e no Perequê. Recentemente foi contratado um professor da própria Prainha Branca, uma vez que era comum os professores antigos, moradores de outros locais, faltarem ou atrasarem por problemas no deslocamento.
Os moradores da Prainha Branca contam com apenas um Posto de Saúde, que funciona em uma pequena casa apenas entre os meses de março a novembro. Na alta temporada, de verão a fevereiro, o Posto de Saúde é desativado para dar espaço temporariamente ao Posto Policial. Nos meses de funcionamento, o Posto recebe a visita de um médico as sextas-feiras para atendimento dos moradores. Além disso, há um agente de saúde da própria comunidade e mais duas enfermeiras do Perequê que fazem visitas pelas manhãs às residências, uma vez por semana. Nos meses em que o Posto de Saúde está desativado, ou mesmo para atendimentos de urgência ao longo do ano, os moradores recorrem aos postos de saúde públicos de Bertioga, devido a maior proximidade, ou ao Pronto Socorro do Perequê, por terem ambulância disponível para o transporte de pacientes em casos de emergência.
O Posto Policial, como já apresentado, funciona apenas durante os meses de dezembro, janeiro e fevereiro, quando o local recebe grande quantidade de turistas. São seis os policiais locados para o trabalho, com expediente entre 7h30 e 19h00.
O abastecimento de água no bairro se dá pela captação em cursos d’água (cachoeira) que descem a vertente do morro voltada para a praia. A água é então armazenada em uma cisterna localizada no próprio morro. Os moradores se mobilizaram para comprar uma tubulação mais resistente e de grande calibre, de onde se ramificam tubulações menores que transportam a água até as residências. Já o esgoto doméstico não é tratado, apenas uma minoria possui fossa séptica, em geral mal vedada e sem limpeza periódica, servindo, dessa forma, apenas como caixa de passagem. A maioria das residências lança seu esgoto diretamente no solo ou em valetas a céu aberto que conduzem o efluente até a praia ou até a lagoa localizada no canto norte da praia, denominado Canto Grosso (Figura 67).
Os resíduos sólidos são recolhidos pelos moradores e três dias por semana (segunda, quarta e sexta-feira) são carregados até a praia, de onde são retirados pela Associação de Moradores com o auxílio de uma lancha e transportados até a Ponta da Praia, próximo da balsa para Bertioga. A empresa Terracom, responsável pela coleta dos resíduos sólidos do local, paga a Associação de Moradores para realizar esse serviço de transporte do lixo até a Ponta da Praia, uma vez que só possui meios de transporte terrestre para realizar o serviço. Além disso, a empresa remunera quatro moradores da Prainha Branca para fazer a limpeza das áreas comuns e o transporte do lixo.
Para sair da Prainha Branca, os moradores precisam caminhar pela extensa trilha, atualmente pavimentada, até o Ponto Final (da Rodovia SP-061). Desse ponto, ou pegam a balsa gratuita até Bertioga, ou pagam por ônibus até o Perequê, de onde podem fazer baldeação para outro ônibus até o centro do Guarujá e Vicente de Carvalho.
A energia elétrica é fornecida pela empresa Elektro desde meados de 1980. Já a comunicação é feita por poucos orelhões presentes no bairro ou por linhas de telefonia fixa existentes há cerca de cinco anos. Muitos moradores possuem aparelho celular, que funcionam apenas em alguns locais com o sinal disponibilizado por uma única operadora. Para recepção de sinais de rádio e televisão a maioria das residências possui antena parabólica.
d) Economia
Até o final da década de 1950 a comunidade da Prainha Branca tinha como meio de vida a pesca e a agricultura de subsistência, além da extração de recursos da mata. A pesca era a principal fonte alimentar e o excedente era comercializado em Bertioga e no mercado municipal de Santos. Os roçados eram compostos basicamente pela mandioca, cana, banana, feijão, rama e café.
Com o início das construções da Colônia de Férias do SESC (Serviço Social do Comércio) em 1947, muitos dos moradores passaram a trabalhar na obra, os homens exercendo funções como pedreiros e ajudantes, e posteriormente com o funcionamento do empreendimento as mulheres nos serviços de limpeza. Ademais, com a pavimentação da Rodovia SP-61 (Guarujá-Bertioga) em 1958, as alternativas de empregos aumentaram devido à melhoria no acesso a Bertioga, Santos e ao centro de Guarujá. Atualmente pode-se observar que os mais jovens, quase que em sua totalidade, procuram postos de trabalho fora da comunidade. Porém, grande parte ainda residente na região, seja por suas “raízes”, pela casa ou terreno próprio.
As principais atividades econômicas e geradoras de renda da população são aquelas relacionadas ao turismo. Estabeleceu-se uma incipiente rede de serviços com pequenos bares, restaurantes e a cessão de porções dos “quintais” das moradias e áreas comuns para a prática do camping.
Alguns moradores trabalham no comércio em Bertioga ou são contratados pela prefeitura do Guarujá para trabalharem na própria Prainha Branca, como professores e agente de saúde. Existem cerca de seis famílias que ainda vivem da pesca, utilizando pequenas embarcações para a captura de peixes e venda na própria comunidade e em Bertioga.
Na região há uma mercearia que vende seus produtos com preços altos. Por esse motivo, a população prefere ir até Bertioga para fazer as suas compras. Além disso, há uma padaria local e alguns bares e restaurantes.
Apesar da falta de infraestrutura, existe uma enorme procura pela região, onde se registra a visitação de aproximadamente cinco mil turistas por dia durante a alta temporada de verão, correspondentes aos meses de dezembro, janeiro e fevereiro, sendo que aproximadamente 1000 pernoitam no local. Os principais atrativos turísticos são as praias, como a própria Prainha Branca, e as duas próximas, a Praia Preta e a Praia do Camburi. Existem também trilhas que passam por trechos de Mata Atlântica com cachoeiras, como a do Camburizinho. Outro atrativo são as ruínas da Ermida do Guaibê e da Fortaleza de São Luis. A Prefeitura do Guarujá criou recentemente a rota dos Jesuítas, que inclui essas ruínas como parte do seu roteiro de atrações. Com recursos da Fundação SOS Mata Atlântica, 19 moradores locais foram capacitados para atuar como monitores ambientais entre 2008 e 2009. No ano seguinte, a Prefeitura do Guarujá ofereceu um curso profissionalizante de dois meses em monitoria ambiental. Desde então, os monitores locais estão organizados e prestam o serviço de guia de turistas desde o Ponto Final, onde começa a trilha para a Prainha Branca.
O lixo produzido e a precariedade das condições de saneamento básico (Tratesgoto, s/d) e o uso intensivo da água das cachoeiras locais são os principais problemas ambientais gerados pela atividade turística.
Nesse sentido a SOS Mata Atlântica vem desenvolvendo projetos para o diagnóstico e o ordenamento do turismo na Prainha Branca (SOS Mata Atlântica, 2002b; 2003), incluindo Operação Praia Limpa, o Multirão de Limpeza de Trilha, dentre outros.
Os moradores locais têm como lazer somente a praia e um camping onde trabalha um rapaz que oferece aulas de futebol. Havia uma sede de moradores onde ocorriam festas, atividades voltadas para crianças, dentre outras atividades sociais. No entanto, um vendaval destruiu a sede no início do ano.
4.3.3. Situação Fundiária
Apesar da grande dimensão do território abrangido pela Serra do Guararu, com cerca de 2.000ha, são poucas as propriedades que constituem esse espaço. Grande parte da Serra do Guararu pertence a extensas propriedades que foram desmembradas e deram origem aos loteamentos Taguaíba, Tijucopava, Iporanga e São Pedro. Juntos, esses loteamentos perfazem uma área de pouco mais de 800 ha, aproximadamente 40% do território da região denominada Rabo do Dragão. Esses loteamentos possuem espaços livres de uso comum, áreas verdes, vias e praças, áreas destinadas a edifícios públicos e outros equipamentos urbanos que são de domínio do município. De acordo com a Lei Municipal n° 2.567/97, essas áreas, embora de domínio público, foram concedidas administrativamente em favor das associações de moradores para fins de conservação e preservação ambiental. Além desses loteamentos, outras grandes propriedades, algumas sem qualquer edificação, constituem a Serra do Guararu. Na Tabela 23 é apresentada uma lista das propriedades levantadas, os números e letras indicativas são os apresentados no mapa de uso e ocupação do solo (Anexo II).
No entanto, uma parte significativa das terras ao longo da Rodovia SP-061, entre o Canal de Bertioga e os morros da Serra do Guararu, onde se situam o bairro Cachoeirinha e as marinas e náuticas, necessitam de regularização fundiária. Situação semelhante é a da Ponta da Armação e da Prainha Branca.
Tabela 23. Levantamento das propriedades situadas na Serra do Guararu.
| Item | Denominação | Proprietário | Cadastro | Matrícula |
| A | Gleba A – Morro da Armação | Fazenda do Estado de São Paulo | 3-0661-145-000 | 53.527 |
| B | Gleba B – Sítio Cambury | Fazenda do Estado de São Paulo | 3-0661-144-000 | 53.526 |
| C |
|
|
|
|
| D | Gleba D | Fazenda do Estado de São Paulo | 3-0661-143-000 | 53.506 |
| E | Gleba E | Fazenda do Estado de São Paulo | 3-0661-146-000 | 69.043 |
| F | Gleba F | Rubens Puccetti | 3-0661-030-000 | Origem 2ª de Santos |
| 1 | Gleba 1 | Rubens O. Carvalho | 3-0661-090-000 | Origem 2ª de Santos |
| 2 | Gleba 2 | Mario Ottobrini | 3-0661-040-000 | 46.009 |
| 3 | Gleba 3 | - José Fernandes | 3-0661-029-000 | 03.294/ 03.295/ 94.517/ 70.641 |
| 4 | Gleba 4 | Evandro Mesquita | 3-0661-058-000 | 93.201 |
| 5 | Gleba 5 | Empreendimentos Imobiliários Praia Preta Ltda | 3-0661-038-000 | 36.805 |
| 6 | Gleba 6 |
|
| 35.864 |
| 7 | Gleba 7 |
|
| Origem 2ª de Santos |
| 8 | Gleba 8 |
|
| 34.778 |
| 9 | Gleba 9 – Sítio Bom Jardim | Bom Jardim Empreend. S/A Ltda | 3-0661-024-000 | 11.186 |
| 13 | Gleba 13 |
|
| 33.938 |
| 14 | Gleba 14 | - Codeara S/A (lote 3-0661-006-000) | 3-0661-000-000 | 92.032/ 93.033/ 93.034/ 58.951/ 23.952/ 56.637/ 22.514/ 22.515/ 02.367/ 53.607/ 26.752/ 53.820/ 53.821/ 43.693/ 59.283/ 01.412/ 87.307/ 87.308/ 87.309 |
| 15 | Gleba 15 |
| 3-0661-074-000 | 98.998/ 98.999 |
| 16 | Gleba 16 | Armando Lichti | 3-0661-065-000 | Origem 2ª de Santos |
| I |
|
| 3-0661-000-000 | Origem 2ª de Santos (espólio de Germano Bresser) |
| II | Praias Preta, Vermelha e Cambury |
|
| 65.307 |
| III | Sítio Sambaqui | - Arcobras (lote 3-0661-007-000) | 3-0661-007-000 | 51.657/ 03.325/ 09.510/ 09.511/ 12.567/ 16.230/ 77.129/ 77.130/ 77.131 |
| IV |
|
| 3-0661-082-000 | Origem 2ª de Santos |
| V |
|
| 3-0661-004-000 | Origem 2ª de Santos |
| VI |
| Francisco Scarpa |
|
|
| VII |
| APLUB |
|
|
| VIII | Loteamento Taguaíba |
|
|
|
| IX |
| Nelson Tamayose |
|
|
| X | Freitas Vale |
|
|
|
| XI | Loteamento Iporanga | Iporanga Empreendimentos Imobiliários e Construções Ltda. |
| 34.869 |
| XII | sem nome |
|
|
|
| XIII | Loteamento São Pedro |
|
|
|
| XIV | Loteamento Tijucopava | Acisa Incorporações Ltda. |
| 70.082 |
| XV | (pega a Marina Tropical) |
|
|
|
| XVI |
| Julio Moreira Simões |
|
|
| XVII |
| Badra S/A |
|
|
| XVIII | Sítio Cachoeira |
|
|
|
|
|
| Banco Ômega |
|
|
4.3.4. Aspectos Históricos e Culturais
No tocante aos aspectos históricos e culturais da região da Serra do Guararu, vale destacar o próprio objeto do processo de tombamento do CONDEPHAAT, a Serra do Guararu e Vila da Prainha Branca (Processo: 26632/88, Resolução: 48 de 18/12/92, Livro do Tombo Arqueológico, Etnográfico e Paisagístico: Inscrição nº 26, pp. 307 e 308, 24/6/1993). O documento aponta a relevância ecológica e histórica da área, como sendo “uma das últimas porções de dimensões significativas de Mata Atlântica, em bom estado de conservação, na planície costeira do litoral central”, além de “faz parte também deste tombamento a Vila da Prainha Branca, por abrigar elementos culturais representativos das comunidades caiçaras”.
Esta região integra o “Circuito dos Fortes” do litoral paulista (o mais importante da América Latina) pela presença da Fortaleza de São Felipe (também denominado Forte de São Luiz). Este circuito foi concebido a partir da descoberta do grande patrimônio histórico e arquitetônico construído ao longo de cinco séculos para a defesa das Vilas de São Vicente e Santos, bem como do Porto de Santos. A representatividade destes Fortes possui várias vertentes: Arquitetônica, pelos estilos e formas; Tecnológica, pelas técnicas e materiais de construção; Política, pelo sistema de organização territorial e defesa; Religiosa, a partir da presença de eminentes religiosos como os Padres Anchieta e Manoel da Nóbrega e Econômica, que representa o incremento de importância a cada ciclo econômico através do porto e Militar, com a evolução das estratégias, armamentos e tecnologia (Prefeitura de Guarujá).
A Fortaleza de São Felipe localiza-se na Ponta da Armação, extremo norte da ilha de Santo Amaro (Rabo do Dragão), onde primitivamente existia uma paliçada para defesa contra os ataques indígenas. Sua construção data do século XVI, foi reconstruído por Morgado de Matheus, na segunda metade do século XVIII, quando passou a denominar-se Forte de São Luiz. Tinha o objetivo de defender o Canal de Bertioga, em conjunto com a artilharia do Forte São João. De acordo com o Livro do Tombo Histórico (inscrição nº 87, p. 10, 23/09/1974), “em 1904, Euclides da Cunha visitou o canal de Bertioga e relatou, por engano, que uma das fortalezas era a de São Felipe, “reduto secular de Hans Staden”. Por esta razão, as ruínas passaram a ter esta denominação e serem confundidas como quinhentista. O forte a que se refere o jornalista e escritor foi edificado em 1557 por Jorge Ferreira, capitão mor da Capitania, e desapareceu sem deixar vestígios em consequência do abandono a que ficou relegado durante todo o século XVII. A fortaleza, tal qual hoje se apresenta, foi construída em 1765, em local estratégico, por ordem do governador da Província, Morgado de Mateus, com a denominação de Forte de São Luiz. Em 1860, o comandante José Olinto de Carvalho teceu elogios à Fortaleza de S. Luiz, apesar de inacabada e servir de Casa de Pólvora. Atualmente, o seu estado de conservação é precário e, em ruínas, subsistem muralhas, as bases das guaritas, muros e pisos em pedras.
O Forte de São Felipe pode ser descrito como um baluarte de pedra, uma casa fortificada para abrigar material pirobalístico (pólvora e munição), voltada para o Canal, na ponta norte da Ilha de Santo Amaro (Guaibe-Guarujá), defronte à Bertioga, próximo ao local onde o Capitão Jorge Ferreira mandou construir, em 1557, o Forte de São Felipe. Apesar de construída para fins militares, a bateria de canhões nunca chegou a ser instalada. Em 1798, passou por uma reforma geral. Hoje restam apenas as muralhas, tombadas pelo IPHAN desde 1965.
Na região da Ponta da Armação também estão localizadas as ruínas da Ermida de Santo Antônio do Guaibê. Este sítio está a 200 m da Armação da Baleia e a caminho do Forte de São Felipe. Esta igreja mantém grande parte de sua estrutura remanescente, no entanto, não recebe manutenção apropriada, apresentando paredes pichadas, excesso de matos e cipós em seu interior e lixos deixados por pessoas.
Observa-se nas ruínas da Ermida a escada e também o antigo altar, que ainda hoje, é utilizado para manifestações de diferentes cultos religiosos. No Livro do Tombo Histórico, sob inscrição nº 123 de 03/07/1979, p. 21, consta que em 1766 o governador Luiz Antônio de Souza Botelho e Mourão, o Morgado de Mateus, ordenou o embargo das obras da Capela de Santo Antônio de Guaibe “por ser em prejuízo da Fazenda de S. Majestade”. No final do século XVIII, as obras foram reiniciadas e concluídas pelo administrador da Armação das Baleias, Francisco José da Fonseca. Em ruínas, em meio a uma densa vegetação, é perceptível a sua técnica construtiva, em alvenaria de pedra e argamassa, muito comum às construções do litoral brasileiro. Por fim, embora considere-se um patrimônio setecentista, muitos estudiosos acreditem tratar-se de ruínas remanescentes de uma capela construída no século XVI, onde José de Anchieta e Manoel da Nóbrega pregavam e catequizavam os índios.
A região também abrigou nos séculos XVIII e XIX a Armação das Baleias. O óleo resultante da pesca das baleias era utilizado para iluminação pública e abastecia cidades como Santos, São Paulo e até o Rio de Janeiro (na época, capital do Brasil). A atividade perdurou por cerca de 200 anos e era comparada em magnitude com aquela desenvolvida no Rio de Janeiro:
Galpões foram construídos ali e no continente para o recolhimento de barbatanas, além de seis grandes tanques para o depósito de óleo de 100 baleias e 12 caldeiras servidas de 30 escravos no “engenho de frigir”, erguidos junto à ermida de Santo Antonio do Guaibê. As baleias eram abundantes nesta faixa litorânea. A atividade durou mais do que as localizadas no centro e norte do Brasil, porque as águas frias do Sul retiveram as baleias por mais tempo, uma vez que as espécies buscavam refúgio às perseguições (PMG, 2006, p. 19).
O local em pouco tempo se tornou um movimentado vilarejo, abrigando inicialmente as casas das pessoas que trabalhavam nas instalações da Armação da Baleia e depois, compradores e visitantes. O velho Forte de São Felipe guardava todos os apetrechos da nova indústria. Além da matança indiscriminada de baleias, a vegetação da região foi em grande parte degradada, abrindo espaço para as novas construções. A lenha proveniente das árvores também era utilizada como combustível para a atividade industrial. Contudo, após a desativação da indústria de óleo de baleia, o povoamento da região foi se diluindo, pois o local já não apresentava atrativos à permanência das pessoas, inclusive devido ao seu isolamento geográfico (Festozo & Reis, 2009).
Atualmente, existem residências de moradores locais na Armação das Baleias sobre algumas ruínas, que ali se instalaram por haver área para atracadouro de embarcação e espaços planos para construção de casas.
O Forte de São Luiz, a Ermida de Santo Antônio do Guaibê e a Armação da Baleia, além das ruinas espalhadas e escondidas pela vegetação das construções que formavam a vila na área, constituem um conjunto arqueológico da época do Brasil Colonial, com estruturas de caráter religioso, comercial e militar, tombados por força do Decreto-Lei Federal nº 25/1937. Além disso, existem vestígios de fornos de barro em diversos pontos da Serra do Guararu, principalmente mais próximos da Ponta da Armação, utilizados nos séculos XVIII e XIX para a produção de carvão decorrente da atividade de pesca e beneficiamento de baleia para a produção de óleo e velas, assim como para abastecer os engenhos de açúcar no século XIX.
Desta forma, tem-se ao longo de toda a extensão do canal de Bertioga e área tombada da Serra do Guararu uma região que dispõe de atrativos históricos, culturais e, sobretudo paisagísticos. As comunidades de Cachoeirinha e Prainha Branca são testemunhas recentes de todo o processo histórico da ocupação da região, seja ainda pela presença de resquícios do patrimônio histórico material (edificações, monumentos, ruínas) como pelas manifestações culturais representadas pelos costumes, práticas, expressões transmitidas em gerações, integrantes do patrimônio histórico imaterial.
Apesar de ser área sob a guarda de diversas formas de proteção legal, entre elas o tombamento pelo Condephaat, a SOS Mata Atlântica, em parceria com a comunidade local, criou a proposta da Estrada Parque da Serra do Guararu utilizando um trecho da Rodovia SP-61. A proposta foi criar um processo de integração para a preservação do patrimônio turístico e ambiental, aproveitando-se do fato de o Departamento de Estradas de Rodagem de São Paulo (DER) já ter denominado a via de Estrada Cênica. Foi criado um plano de manejo e a construção de portais, sinalizações e programas de preservação envolvendo a comunidade local (Conde, 2009).
A estratégia utilizada pela SOS Mata Atlântica baseou-se na formalização de acordos jurídicos entre as partes interessadas, com emprego do Termo de Autorização e Compromisso entre a SOS e o DER (DER-SP n°. 005 de 05 de setembro de 2002) em conjunto com a Sociedade dos Amigos do Iporanga (SASIP). No entanto, essa categoria não é amparada pelo Sistema Nacional de Unidades de Conservação (SNUC), e o estado de São Paulo não contempla também a categoria Estrada-Parque no seu Sistema Estadual de Unidades de Conservação (SEUC), como acontece em Tocantins, Mato Grosso e Rio Grande do Sul (Soriano, 2006). Assim, a Estrada-Parque, não possuindo respaldo legal do SNUC, fica a mercê da boa vontade de todos os parceiros, principalmente quando de mudanças de governos e ou lideranças nas associações. Dessa forma, pode somente ser considerada uma estratégia de mobilização, gestão e mesmo de auto-gestão, embora de modo extremamente relevante, como definido pelos próprios propositores.
5. CONSIDERAÇÕES FINAIS
A Serra do Guararu, situada na Região Leste no Município do Guarujá, mais conhecida como Rabo do Dragão, abrangendo um território de 1.983,39 ha, tombada como Patrimônio Natural, representa uma das últimas porções de dimensões significativas de Mata Atlântica, em bom estado de conservação, na planície costeira do litoral central, sendo um dos poucos corredores de ligação entre o oceano e a serra do mar, não comprometido pela urbanização intensa.
Constituída quase que totalmente por morros cristalinos (migmatitos-granitos), com amplitudes topográficas em torno de 240 a 320 m, declividades médias das encostas superiores de 30 a 45%, e perfis variando de convexos a retilíneos, aliado ao alto índice pluviométrico, propiciado pela proximidade com o oceano Atlântico, que fornece abundância de umidade, a área destaca-se pela alta fragilidade e suscetibilidade a movimentos rápidos e intensos de ruptura do equilíbrio geoecológico, sobretudo quando da intervenção antrópica extensiva e desordenada.
A cobertura vegetal predominante da Mata Atlântica cumpre um papel fundamental de proteção à frágil estabilidade das encostas, atenuando a ação do escoamento superficial, dos processos erosivos e dos movimentos de massa.
Neste estudo, foram identificadas 8 fitofisionomias na vegetação na Serra do Guararu: Floresta Ombrófila Densa Médio e Baixo Montana, Floresta Ombrófila de Terras Baixas (Floresta de Restinga), Floresta de Restinga Paludosa, Escrube de Restinga, Manguezal, Vegetação de Dunas e Vegetação Rupestre de Costão Rochoso. A Floresta Ombrófila Densa é a formação vegetal de maior cobertura ocupando quase a totalidade da área analisada.
Rica em biodiversidade, a Serra do Guararu é considerada o último trecho remanescente de Mata Atlântica intacto da Ilha de Santo Amaro. Em sua maior parte a área possui matas em estágio médio a avançado de regeneração com grande biodiversidade de espécies vegetais e animais. O palmito-juçara e o xaxim (ameaçados de extinção) ainda podem ser encontrados, além das figueiras (Ficus spp.), jequitibás (Cariniana sp.), jatobá (Hymenaea courbaril), sapucaias (Lecythis spp.) e grande variedade de bromélias e orquídeas.
A diversidade de fitofisionomias compreendidas na mesma região, o razoável grau de conservação e integridade da vegetação nativa, e a proximidade com UCs de proteção integral são argumentos que destacam a Serra do Guararu como uma área indicada para a implantação de uma Unidade de Conservação, no mínimo de Uso Sustentável.
Embora não haja muitos dados coletados diretamente na Serra do Guararu, a área se insere numa região ainda bem preservada, com significativos registros de fauna silvestre, que incluem várias espécies endêmicas e ameaçadas de extinção. Podem-se observar aves como tucanos, pica-paus, tiés-sangue, saíras-sete-cores, maritacas e gaviões diversos. Também estão presentes espécies de mamíferos como onça-parda, jaguatirica, tamanduá-mirim, bicho-preguiça, veado-mateiro, paca, tatus e gambás, sendo alguns deles muito comuns na área. Além disso, há ainda centenas de outros animais menores que caracterizam o bioma. Embora tenha uma fauna diversificada, a serra do Guararu já perdeu espécies (notadamente de aves e mamíferos) em função da ocupação e exploração pretérita, e carece de alguns elementos importantes em guildas chave para a manutenção da floresta em longo prazo. Entretanto, as condições de preservação e governança territorial exibidas pela área a tornam um local ideal para a reintrodução monitorada dessas espécies, que incluem animais ameaçados de extinção com pouco habitat disponível, tais como o mono-carvoeiro e a jacutinga.
Adicionalmente, as encostas da Serra do Guararu guardam tesouros arqueológicos que levaram o Conselho de Defesa do Patrimônio Histórico, Arquitetônico e Arqueológico do Estado (Condephaat) a tombar a área. No entanto, a Ermida de Santo Antônio do Guaibê, sítio que constitui um importante patrimônio arqueológico da região, juntamente com a Armação das Baleias e o Forte São Felipe, se encontram em ruínas. O Forte São Felipe cruzava fogo com o Forte São João, que fica do lado de Bertioga, impedindo a entrada de barcos pelo Canal em direção a São Vicente e Santos. A serra também testemunhou a partida da expedição de Estácio de Sá, que acabou por fundar a cidade do Rio de Janeiro. Segundo registros oficiais, a área começou a ser ocupada, de fato, a partir de 1840, por famílias que migraram de São Sebastião e da Ilha Montão de Trigo.
Além da importância em termos arqueológicos e de biodiversidade, a área também abriga centenas de nascentes que alimentam o Rio Iporanga e demais cursos d’água, que cortam a Serra do Guararu. É importante também ressaltar a beleza cênica da região, com várias praias, restingas, cachoeiras, manguezais e costões rochosos. A preservação da área é essencial para que a utilização recreacional destas praias e demais atrativos não comprometa as suas características naturais e cause mínimo impacto à biodiversidade, paisagem e serviços ambientais da Serra do Guararu.
Os remanescentes da Mata Atlântica, tanto por sua relevância biológica, quanto pelo fornecimento de inúmeros serviços ambientais voltados para nosso usufruto (ex. fornecimento de água, tamponamento do clima, conservação de solos, etc.), precisam de instrumentos legais e do estabelecimento de estratégias para uso sustentável e conservação. Dentre essas estratégias, o estabelecimento de corredores ecológicos, e outras formas de conexão para ligar as diversas áreas de conservação, é adequado para minimizar perdas de espécies e de variabilidade genética (as quais estão associadas com a fragmentação e isolamento dos remanescentes). Uma vez que a Mata Atlântica se encontra muito reduzida e ainda sofre grande pressão antrópica, é importante que se estabeleça uma rede interligada e coesa de áreas protegidas, englobando o maior número possível de remanescentes naturais capazes de conservar a biodiversidade e/ou fornecer serviços ambientais relevantes, para garantir a manutenção de fluxos gênicos e ecológicos através de todo o ecossistema.
O desenvolvimento da região leste do município do Guarujá vem sofrendo alterações devido ao crescimento urbanístico desde a construção da Rodovia Ariovaldo de Almeida Viana (SP-61), na década de 50. Particularmente em uma área de 2.600 ha abrangendo entre a Praia do Perequê e o Morro da Armação, que foi denominada pelo Plano Diretor Regional como Região Leste I, e principalmente as faixas litorâneas e ao longo do Canal de Bertioga.
A ocupação desta região ocorreu através da instalação de condomínios residenciais, marinas e clubes, e, por outro lado, de moradias populares em morros e casas de comércio.
Em 1996, a Secretaria do Meio Ambiente do Estado de São Paulo publicou a Resolução SMA-59, na qual aprova o “Plano Piloto de Desenvolvimento Turístico da Região Leste do Guarujá”, que propõe o zoneamento da Serra do Guararu em três níveis diferentes de ocupação e, sugeriu a criação de uma RPPN, que seria criada e mantida pelos próprios proprietários da região como estratégia de conservação da Mata Atlântica e seus remanescentes. Essa ideia surgiu após uma tentativa de invasão que ocorreu no mesmo ano, embora pouco tenha avançado até hoje.
Analisando as decisões da Secretaria do Meio Ambiente do Estado, a Câmara Municipal do Guarujá outorgou a Lei Complementar nº 043, de dezembro de 1998, que estabelecia cinco zonas de ocupação, duas delas permitindo ampla utilização urbana (B.1 – Zona de Baixa Densidade e B.2 – Zona de Alta Densidade); outra de uso restrito (UR – Zona de Uso Restrito) e duas com orientação ambiental (V – Zona Verde e P – Zona de Preservação). Posteriormente, instituiu-se um Plano Diretor para a Região Leste do Guarujá.
Atualmente, a Serra do Guararu foi classificada, pelo novo Plano Diretor Participativo de Lei de Uso e Ocupação do Solo (dezembro de 2006), como Macrozona de Proteção Ambiental (área de preservação e ocupação dirigida). Já as Zonas de ocupação foram classificadas como Zona de Baixa Densidade (urbana), Zona especial de Interesse Turístico e Zona Especial do Interesse do Patrimônio (ambiental).
Em relação à sua proteção, a Serra do Guararu sofre atualmente críticas ameaças devido ao avanço urbanístico desordenado e irregular especialmente em áreas de APP. A maior pressão sobre esse ambiente se dá pela especulação imobiliária e pelos enormes contrastes sociais entre a população residente, cerca de 1.200 moradores e os condomínios de alto padrão, além do turismo descontrolado. Os 1.200 moradores na área concentram-se nas duas maiores comunidades, a da Cachoeirinha e da Prainha Branca. Além disso, a Praia do Perequê é vizinha à área tombada e representa um grande vetor de pressão antrópica sobre a Serra do Guararu. Segundo Mele (2009), a população residente no Perequê avançou nos últimos anos de maneira expressiva, gerando gravíssimos problemas de saneamento básico, de segurança pública e de agressões à fauna e flora.
Na tentativa de promover a conservação da região, foi criada a Estrada-Parque da Serra do Guararu (nos trechos compreendidos entre o Km 8,5 e o Km 22 da SP - 61) através de iniciativa da S.O.S. Mata Atlântica, em conjunto com a Sociedade dos Amigos do Iporanga (SASIP), mediante acordo formal entre essa e o DER - Departamento de Estradas de Rodagem de São Paulo (Termo de Autorização e Compromisso DER-SP nº. 005 de 05/09/2002) e termos de compromisso com associações de moradores locais.
A iniciativa faz parte do Projeto Guararu, que consiste na implantação de um modelo de desenvolvimento sustentável baseado na gestão integrada e participativa, na valorização dos patrimônios históricos e culturais, e no envolvimento das comunidades locais e dos agentes que interferem na conservação dos ecossistemas da região (Fundação S.O.S. Mata Atlântica, 2004).
A despeito da grande importância ecológica e social da Serra do Guararu, a estrada-parque somente pode ser considerada uma estratégia de mobilização, gestão e mesmo de autogestão, embora de modo extremamente relevante, como definido pelos próprios propositores. Por não possuir respaldo legal do SNUC, a Estrada-parque fica a mercê da boa vontade de todos os parceiros, principalmente, quando de mudanças de governos e/ou lideranças nas associações.
A Área tombada da Serra do Guararu, por sua posição geográfica (NE da ilha de Santo Amaro) não possui uma conectividade direta (limite físico, sobreposição) com outras unidades do sistema de proteção ambiental da Mata Atlântica. No entanto, seu tamanho, localização e grau de preservação, a qualificam como um remanescente importante, num contexto regional, fazendo parte de todo um complexo de áreas protegidas do litoral paulista, que ainda abrange complexos estuarinos e unidades de conservação estaduais e municipais de várias categorias. Dentre essas destaca-se o Parque Estadual da Serra do Mar ao norte, o Parque Estadual Xixová-Japuí (em Praia Grande, a oeste), o recém criado Parque Estadual da Restinga de Bertioga a norte, e as Áreas Naturais Tombadas do Morro do Botelho e do Morro do Monduba (em Guarujá, extremo sudoeste da ilha de Santo Amaro).
Em escala local, também se ressalta a proximidade de outras importantes áreas referidas no Plano Diretor municipal, tipificadas como “Macrozonas de Proteção Ambiental”, no sentido sudoeste/nordeste da Ilha de Santo Amaro, sendo, Morros da Glória, do Botelho, da Cachoeira, do Engenho e da Cana, além da grande formação geomorfológica longitudinal correspondente a Serra de Santo Amaro.
Embora não ocupe uma posição central no referido complexo, a Serra do Guararu e adjacências representam uma das poucas áreas significativas da Baixada Santista (e talvez de todo o litoral paulista) onde a continuidade do gradiente de ecossistemas naturais, que inclui oceano, estuários e florestas costeiras, se manteve livre de um processo de antropização mais severo, desencadeado pela urbanização. Apesar da ocupação histórica da maioria das praias, e da retirada de parte considerável das florestas da planície costeira pela implantação de loteamentos, a área da serra ainda se mantém livre dos aglomerados urbanos e dos seus drásticos efeitos, que incluem: alteração, perda, compactação e impermeabilização de solo, poluição das águas fluviais e costeiras, remoção da vegetação, aumento de temperatura e diminuição generalizada de umidade, geração intensa de resíduos, entre outros. Desse modo, a Serra do Guararu é parte importante de um dos poucos corredores onde os fluxos naturais característicos da zona costeira ainda acontecem sem atravessar diretamente uma área de alteração intensa (porém, ainda sujeitos às interferências que se propagam da vizinhança via atmosfera e meio marinho).
Em 2009, foram instituídas duas RPPNs na Serra do Guararu: Marina do Conde e Tijucopava, ambas geridas pelo Instituto Litoral Verde (ILV). Mesmo tendo áreas de propriedades privadas e protegidas constitucionalmente, a Serra do Guararu vem sofrendo com o avanço urbanístico em meio à beleza cênica da Mata Atlântica. Portanto, é de fundamental importância que a UC seja criada.
Por fim, segundo o mapa de áreas prioritárias para conservação e uso sustentável da biodiversidade (Portaria MMA 9 de 23/01/2007), a Serra do Guararu está inserida em área de importância extremamente alta (MaZc170 – Canal de Bertioga).
Em resumo, a UC teria como objetivos principais:
• Preservar amostras representativas de vários ecossistemas naturais presentes na área;
• Proteger as espécies endêmicas e ameaçadas de extinção presentes nos referidos ecossistemas e possibilitar o manejo de espécies-chave, através do enriquecimento e/ou reintrodução;
• Incentivar a realização de pesquisas científicas na área;
• Conservar os serviços ambientais e garantir a manutenção das características físicas naturais e paisagem, por meio do controle dos locais de maior fragilidade e de riscos de ocorrência de processos degradadores (poluição do solo e água);
• Conservar a cobertura vegetal como forma de proteção do solo, das nascentes e cursos d’água;
• Conservar o património arqueológico e cultural;
• Contribuir para a manutenção da Reserva da Biosfera da Mata Atlântica e sistema de Unidades de Conservação públicas e privadas da Mata Atlântica;
• Promover a educação ambiental dos proprietários e funcionários dos Loteamentos, marinas e das comunidades locais;
• Contribuir para o desenvolvimento sustentável das comunidades locais;
• Contribuir para o desenvolvimento de um turismo sustentável (arqueológico, cultural e ecológico).
6. REFERÊNCIAS BIBLIOGRÁFICAS
Ab´Sáber, A. 2003. Os Domínios de Natureza no Brasil. São Paulo: 1° Ed. Ateliê Editorial. 159 p.
Ab´Saber, A. N. 1986.O tombamento da Serra do Mar no Estado de São Paulo. Revista do Patrimônio Histórico e Artístico Nacional. Nº 21, Rio de Janeiro.
Ab’Saber, A. N. 1965. A Evolução Geomorfológica. In: AZEVEDO, A. Baixada Santista: as Bases Físicas. Editora da Universidade de São Paulo. V.1, cap. 2, p. 49-66. São Paulo.
Almeida, F. F. M, de. 1953. Considerações Sobre a Geomorfogênese da Serra de Cubatão. Boletim Paulista de Geografia. V. 15, p. 13-17.
Almeida, F. M. de. &Carneiro, C. dal R. 1998. Origem e Evolução da Serra do Mar. Revista Brasileira de Geociências. São Paulo, v. 28, n. 2, jun. pp.135-150.
Ambiental Consulting. 2008. Plano de Manejo da Área de Preservação Ecológica na Serra do Guararu. Loteamento Iporanga, Guarujá, SP. São Paulo: Ambiental Consulting/SASIP.
Ayoade, J.O. 2003. Introdução à Climatologia Para os Trópicos. 6ªEd. São Paulo: Bertrand Brasil. 332 p.
Bistrichi, C.A. 1981. Mapa geológico do Estado de São Paulo. 1:500.000. In: ALMEIDA, F.F.M. Mapa geológico do Estado de São Paulo.1:500.000, texto. São Paulo, IPT, 2v. IPT – Publicação 1184, Série Monografias 6.
Boldrin, A.H.L. & Prado, J. 2007. Pteridófitas terrestres e rupícolas do Forte do Andradas, Guarujá, São Paulo, Brasil. Bol. Bot. da Univ. de São Paulo, 25 (1): 1- 69.
Carvalho, R. J. S. 2010. Territorialidade da comunidade de pescadores artesanais: Praia do Perequê, Guarujá, SP. Dissertação (Mestrado em Desenvolvimento Local) – Universidade Católica Dom Bosco. Campo Grande, UCDB.
Cavalcanti, I.F.A; Ferreira, N.J; Silva, M.G.A. J. & Dias, M.A.F.S. 2009.Tempo e Clima no Brasil. São Paulo:Oficina de Textos. 463 p.
CMA - Consórcio Mata Atlântica. 1992. Reserva da Biosfera da Mata Atlântica. Plano de Ação. v.1. Referências Básicas. Campinas: Univ. Estadual de Campinas.
Conde, C. A. R. 2009. Estrada Parque, uma estratégia sustentável. Revista Pós, São Paulo, 16 (25): 152-165.
Conti, L.A. & Furtado, V.V. 2006. Geomorfologia da Plataforma Continental do Estado de São Paulo. Revista Brasileira de Geociências36: 305-312.
CPRM - Serviço Geológico do Brasil. 2006. Mapa Geológico do Estado de São Paulo. Escala 1:750.000. Ministério de Minas e Energia. v. 02.
Cunha-Linhon, M.; Menghini, R. P.; Cavalcanti, L. S. M.; Niemeyer-Dinóla, C.&Schaeffer-Novelli, Y. 2009. Estudos de Caso nos Manguezais do Estado de São Paulo (Brasil): Aplicação de Ferramentas com Diferentes Escalas Espaço-Temporais. Revista da Gestão Costeira Integrada 9 (1): 79 – 91.
DAEE - Departamento de Águas e Energia Elétrica. 1982. Mapa Geológico do Estado de São Paulo. 1:250.000. São Paulo: UNESP.
DAEE: Departamento de Águas e Energia Elétrica. 1977. Levantamento de Dados Referentes a Padrões de Circulação das Águas do Estuário e Baia de Santos. CETESB.
Domingues, E.N. 2001. Caracterização das Feições Erosivas e Relações com o Meio Hidrobiofísico em Áreas Impactadas da Serra do Mar, na Região de Cubatão (SP). Revista Brasileira de Geociências, 20 (1): 61-71. São Paulo: UNESP.
Durigan, G.; Ivanauskas, N. M.; Nalon, M. A.; Ribeiro, M. C.; Kanashiro, M. M.; Costa, H. B. & Santiago, C. de M. 2009. Protocolo de avaliação de áreas prioritárias para a conservação da Mata Atlântica na região da Serra do Mar/Paranapiacaba. Rev. Inst. Flor., São Paulo, 21 (1): 39 - 54.
EMBRAPA - Empresa Brasileira de Pesquisa Agropecuária. 1999. Sistema Brasileiro de Classificação de Solos. Brasília: EMBRAPA. 412p.
Ferreira, A.L; Coutinho, B.R.; Pinheiro, H.T. & Thomaz, L. 2007. Composição florística e formações vegetais da Ilha dos Franceses, Espírito Santo. Bol. Mus. Biol. Mello Leitão (n. sér.) 22: 25 - 44.
Festozo, M. B. & Reis, M. F. C. T. 2009. A contribuição da história para Educação AMBIENTAL em Comunidades. Rev. Eletrônica Mestr. Educ. Ambient., FURG-RS, 23 (julho/dezembro): 147-167.
Francini, Ronaldo Bastos; 2010. História Natural das borboletas do Vale do Rio Quilombo, Santos, SP. Santos, SP, E-book Publicado pelo autor. 300 p., il.
Francini, R. B.; Duarte, M.; Mielke, O. H. H.; Caldas, A. & Freitas, A. V. L. 2011. Butterflies (Lepidoptera, Papilionoidea and Hesperioidea) of the "Baixada Santista" region, coastal São Paulo, southeastern Brazil. Rev. Bras. Entomol55(1):55-68.
Fruehauf, S.P. 2005. Rhizophora mangle (Mangue Vermelho) em áreas contaminadas de Manguezal na Baixada Santista. Tese de Doutorado. Ecologia de Agroecossistemas – Escola de Agricultura “Luiz de Queirós”. USP. Piracicaba - SP. 223p.
Fulfaro, V. J; Suguio, K. & Ponçano, W. L.. 1974. A Gênese das Planícies Costeiras Paulistas. In: CONGRESSO BRASILEIRO DE GEOLOGIA, 28, Porto Alegre - Anais. Porto Alegre: SBG, v. 3, p. 37-42.
Fundação Florestal, WWF-Brasil & Instituto Ekos, 2008. Diagnóstico Sócio Ambiental para Criação de Unidades de Conservação no Estado de São Paulo – Polígono Bertioga.
Guedes e Silva, D. 2004. Florística, Estrutura e informações sobre a regeneração natural de fragmentos de Floresta de Restinga no município de Bertioga-SP. Dissertação de Mestrado. Instituto de Geociências e Ciências Exatas, Univ. Estadual Paulista- Rio Claro.
Guedes e Silva, D.; Barbosa, L.M. & Martins, S.E. 2006. Composição florística e estrutura fitossociológica de dois fragmentos de floresta de restinga no Município de Bertioga, SP. Brasil. Acta Bot. Bras. 20 (2): 299-311.
Guerra, A.J.T. & Cunha, S.B. 2003. Geomorfologia do Brasil. 3° Ed. Rio de Janeiro: Bertrand Brasil. 392p.
Hasui, Y.; Gimenez, A.F. & Melo, M.S. 1978. Sobre as Bacias Tafrogênicas do Sudeste Brasileiro. In:Congresso Brasileiro de Geologia. 1978. Anais. Recife: SGB. v. 01. pp. 382-392
IBGE - Instituto Brasileiro de Geografia e Estatística. 2010a. Resultados Preliminares do Universo do Censo Demográfico 2010. Rio de Janeiro: IBGE.
________. 2010b. Assistência Médica Sanitária 2009. Rio de Janeiro: IBGE.
________. 2006. Censo Agropecuário 2006. Rio de Janeiro: IBGE.
________. 2000. Dados do Censo 2000. Rio de Janeiro: IBGE.
________. 1991. Dados do Censo 1991. Rio de Janeiro: IBGE.
________. 1980. Dados do Censo 1980. Rio de Janeiro: IBGE.
Instituto de Botânica de São Paulo &FAPESP. 2008. Diretrizes para Conservação e Restauração da Biodiversidade no Estado de São Paulo. São Paulo: FAPESP/SMA-SP.
Instituto Ekos. 2008. Diagnóstico Sócio Ambiental para Criação de Unidades de Conservação no Estado de São Paulo – Polígono Bertioga.Relatório Final. São Paulo: Instituto Ekos, Fundação Florestal & WWF-Brasil.
IPT: Instituto de Pesquisas Tecnológicas. 1986. Programa Serra do Mar – Levantamentos Básicos nas Folhas de Santos e Riacho Grande, Estado de São Paulo. Anexo – A. Estudos Geológicos e Geomorfológicos. São Paulo. Relatório 23.394. V. 2. 120p.
IPT - Instituto de Pesquisas Tecnológicas. 1994. Carta Geotécnica do Estado de são Paulo. São Paulo. 1° Ed.
________. 1981a. Mapa Geológico do Estado de São Paulo.1:500.000, texto. São Paulo, IPT, 2v. IPT – Publicação 1184, Série Monografias 6.
________. 1981b. Mapa Geomorfológico do Estado de são Paulo. 1:1.000.000. São Paulo.
Jorge, M.C.O. 2004. Zoneamento Ambiental do Município de Ubatuba – SP. Dissertação de Mestrado. Instituto de Geociências e Ciências Exatas - UNESP. Rio Claro.
JGP. 1999. Área de Preservação Ecológica na Serra do Guararu – Loteamento Iporanga – Guarujá. Plano de Manejo. São Paulo, SP.
Lacerda, M. S. 2001. Composição florística e estrutura da comunidade arbórea num gradiente altitudinal de Mata Atlântica. Tese de Doutorado. Instituto de Biologia da Universidade Estadual de Campinas. 166p.
Leitão-Filho, H. F. 1987. Considerações sobre a florística de Florestas Tropicais e Sub-Tropicais do Brasil. IPEF (35): 41-46.
Lopes, E.A. 2007. Formações Florestais de planície costeira e baixa encosta e sua relação com o substrato geológico nas bacias dos Rios Itaguaré e Guaratuba (Bertioga-SP). Dissertação de Mestrado. Instituto de Botânica. Secretaria do Meio Ambiente do Estado de São Paulo.
Lorenzi, H. 1992. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. Editora Plantarum. Vol.1: 352p.
Lorenzi, H. 1998. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. Editora Plantarum. Vol.2. 352p.
Matos, J. N. 1925. O Clima de São Paulo. Secretaria da Agricultura, Comércio e Obras Públicas do Estado de São Paulo. Serviço Meteorológico. Nº 38. São Paulo,
MEC - Ministério da Educação / INEP - Instituto Nacional de Estudos e Pesquisas Educacionais. 2009. Censo Educacional 2009. Disponível em: http://www.inep.gov.br
Mele, J. L. 2009. Projeto de Conservação e Segurança Ambiental – Serra do Guararu. Relatório interno. Guarujá: ISSA.
Miyazaki, S.L. 2009. Análise de estrutura, chuva de sementes e regeneração natural de populações de plantas em floresta de restinga alta, São Vicente-SP. Tese de Doutorado. Instituto de Botânica de São Paulo. 95p.
MME - Ministério de Minas e Energia. 1983a. Mapa de Avaliação do Relevo. 1:1.000.000. Levantamento de Recursos Naturais, Projeto RADAMBRASIL.
________. 1983b. Mapa Exploratório de Solos. 1:1.000.000. Levantamento de Recursos Naturais, Projeto RADAMBRASIL.
Monteiro, C. A. de F. 1973. A dinâmica climática e as chuvas do estado de São Paulo: estudo em forma de Atlas. Instituto de Geografia, Universidade de São Paulo.
Oliveira, D.& Neto, J.P.Q. 2007. Evolução do Relevo na Serra do Mar no Estado de São Paulo a Partir de Uma Captura Fluvial. Revista GEOUSP Espaço e Tempo, 22: 73-88.
Paula, J.P.L; Zaine, J.E; Lima, M.S. & Oliveira, E.M. 2008. Análise Fisiográfica Aplicada à Elaboração de Mapa Geológico-Geotécnico de Região da Serra do Mar e Baixada Santista. Revista Brasileira de Geociências, 27 (2): 249-264.
PMG - Prefeitura Municipal de Guarujá. 2006. Plano Diretor do Município de Guarujá. Guarujá: PMG.
PNUD; IPEA & Fundação João Pinheiro. 2003. Atlas Do Desenvolvimento Humano no Brasil. Rio de Janeiro: PNUD, IPEA, Fundação João Pinheiro.
Rodrigues, R.R e Bononi, V.L.R. 2008. Diretrizes para a Conservação e Restauração da Biodiversidade no Estado de São Paulo. Ricardo Ribeiro Rodrigues e Vera Lucia Ramos Bononi orgs. São Paulo: Instituto de Botânica. 248p il.
Rodrigues, S.O.; Camparelli, C.C., Moura, D.O.& Bruni, A.C. 1995. Os manguezais da Baixada Santista: uma proposta para classificação. 1. Oecologia Brasiliensis - Estrutura, funcionamento e manejo de ecossistemas brasileiros.
Ross, J.L.S. 2009. EcoGeografia do Brasil. Subsídios para o Planejamento Ambiental. São Paulo: Oficina de Textos. 208 p.
Ross, J.L.S. 2003. Geografia do Brasil. 4° Ed. 1° Reimpressão. São Paulo: EDUSP. 549 p.
Sant´Anna Neto, J. L. 1997. Ritmo climático e as chuvas na zona costeira paulista. Dissertação de Mestrado. Departamento de Geografia, Universidade de São Paulo.
Santos, E.O. 1965. Características Climáticas. In: Azevedo, A. A Baixada Santista – Aspectos Geográficos. v. 01. As Bases Físicas. São Paulo: EDUSP. pp. 95-150.
Schaeffer-Novelli, Y. 1991. Manguezais brasileiros. Tese de Livre Docência, Instituto Oceanográfico, Universidade de São Paulo. SãoPaulo, SP, Brasil. 42p
Schmiegelow, J.M.M. 2009. Manguezais do Sistema Estuarino de Santos (SP): Estrutura e Produção de Serapilheira. Tese de Doutorado. Instituto Oceanográfico - USP. São Paulo.
Secretaria do Meio Ambiente. 2005. Manual de reconhecimento de espécies vegetais da restinga do Estado de São Paulo. 439p.
SEADE - Fundação Sistema Estadual de Análise de Dados. 2010. Perfil Municipal: Guarujá. Disponível em: www.seade.gov.br.
Siqueira, M. F. 1994. Análise florística e ordenação de espécies arbóreas da Mata Atlântica, através de dados binários. Dissertação de Mestrado. Instituto de Biologia da Universidade Estadual de Campinas. 143 p.
SMA - Secretaria de Estado do Meio Ambiente de São Paulo. 1998. Anteprojeto de lei para o Sistema Estadual de Unidades de Conservação. São Paulo: SMA. 44 p.
Soriano, A. J. S. 2006. Estrada-Parque: uma proposta para uma definição. Tese (Doutorado em Geografia), Instituto de Geociências e Ciências Exatas, Universidade Estadual Paulista, Rio Claro.
SOS Mata Atlântica. s/d. Proposta de atuação e gestão integrada para a Serra do Guararu, Guarujá, SP. Relatório Interno. Programa de Conservação da Serra do Guararu. São Paulo: Fundação SOS Mata Atlântica.
________. 2004. Caracterização Socioambiental da Prainha Branca, Serra do Guararu, Guarujá, SP. Relatório Interno. São Paulo: Fundação SOS Mata Atlântica.
________. 2003. Avaliação dos Impactos do Turismo na Prainha Branca, Guarujá, SP. Relatório Interno. São Paulo: Fundação SOS Mata Atlântica.
________. 2002a. Diagnóstico Socioambiental da Comunidade Cachoeirinha, Serra do Guararu, Guarujá, SP. Relatório Interno. São Paulo: Fundação SOS Mata Atlântica.
________. 2002b. Projeto de Manejo da Trilha de Acesso à Prainha Branca, Guarujá, SP. Relatório Interno. São Paulo: Fundação SOS Mata Atlântica.
Souza, C.R.G.; Hiruma, S.T.; Sallun, A.E.M.; Ribeiro, R.R.& Sobrinho, J.M.A. 2008. “Restinga”. Conceitos e Empregos do Termo no Brasil e Implicações na Legislação Ambiental. São Paulo:Instituto Geológico - Secretaria do Meio Ambiente. 104p.
Souza, K. M.; Arfelli, C. A.; Graça Lopes, R. & Rodrigues da Silva, N. J. 2011. A percepção dos integrantes da cadeia produtiva da pesca do camarão-sete-barbas (Xiphopenaeuskroyeri) do Perequê (Guarujá, SP) sobre a Política Pública do defeso. V Simpósio Brasileiro de Oceanografia – Oceanografia e Políticas Públicas. Santos: SOB.
Souza, K. M.; Arfelli, C. A. & Graça Lopes, R. da. 2009a. Perfil socioeconômico dos pescadores de camarão-sete-barbas (Xiphopenaeus kroyeri) da praia do Perequê, Guarujá (SP). Bol. Inst. Pesca, São Paulo, 35 (4): 647-655.
Souza, K. M.; Rodrigues da Silva, N. J.; Graça-Lopes, R. da & Arfelli, C. A. 2009b. Análise da política pública do defeso do camarão-sete-barbas (Xiphopenaeus kroyeri) na comunidade pesqueira do Perequê (Guarujá, São Paulo, Brasil). Leopoldianum – Revista de Estudos e Comunicações da Universidade Católica de Santos, 97: 61-71.
Souza, K. M.; Casarini, L. M.; Henriques, M. B.; Graça-Lopes, R. da & Arfelli, C. A. 2009c. Viabilidade econômica da pesca de camarão-sete barbas com embarcação de pequeno porte na praia do Perequê, Guarujá, Estado de São Paulo. Informações Econômicas, 39(4): 30-37.
Suguio, K. & Martin, L. 1978a. Mapa Geológico do Estado de São Paulo – Folhas Santos, Itanhaém e Peruíbe. Escala 1:1.000.000.Secretaria de Obras Meio Ambiente/ Departamento de Águas e Energia Elétrica. São Paulo.
Tabarelli, M. & Mantovani, W. 1999. A riqueza de espécies arbóreas na floresta atlântica de encosta no estado de São Paulo (Brasil). Rev. Bras. Bot. 22 (2): 217-223.
Tratesgoto Engenharia. s/d. Relatório de avaliação das condições sanitárias da comunidade da Prainha Branca. Relatório Interno para a Fundação SOS Mata Atlântica.
Tulik, O. 1981. Praia do Góis e Prainha Branca - Núcleos de Periferia urbana na Baixada Santista. 1. ed. São Paulo: Fundo de Pesquisas do Museu Paulista da USP. 241 p.
Urbanetz, C. 2010. Fatores abióticos e variação espacial na estrutura da Floresta Ombrófila Densa Atlântica. Tese de Doutorado. Instituto de Biologia Vegetal, Campinas. 114 p.
Vannucci, M. 1999. Os Manguezais e nós: uma síntese de percepções. São Paulo: EDUSP. 233 p.
Viana, V. M. & Pinheiro, L.A.F.V. 1998. Conservação da biodiversidade em fragmentos florestais. IPEF12 (32): 25-42.
Vicenssotti, L. 2010. Processo de Reforma Macroorganizativa da Administração Municipal de Guarujá. Guarujá: Strategia.
WWF-Brasil. 2011.Visão da Biodiversidade da Ecorregião Serra do Mar – Domínio Biogeográfico Brasília: WWF-Brasil
Sites:
AGEM: Agência Metropolitana da Baixada Santista. Disponível em:
http://www.agem.sp.gov.br/mapas/mapas_principal.htm.
EMPLASA: Empresa Paulista de Planejamento Metropolitano S.A. Disponível em: http://www.emplasa.sp.gov.br.
IBAMA. Disponível em:
http://www.ibama.gov.br/ecossistemas/mata_atlantica.htm.
IBGE - Instituto brasileiro de Geografia e Estatística. Disponível em www.ibge.gov.br.
RBMA: Reserva da Biosfera da Mata Atlântica. Disponível em: http://www.rbma.org.br/anuario/mata_06_smar_asp_bio_flora.asp
Jardim Botânico do Rio de Janeiro.Disponível em:
http://floradobrasil.jbrj.gov.br/2010/Forzza, R.C.; Leitman, P.M.; Costa, A.F.; Carvalho Jr., A.A.; Peixoto, A.L.; Walter, B.M.T.; Bicudo, C.; Zappi, D.; Costa, D.P.; Lleras, E.; Martinelli, G.; Lima, H.C.; Prado, J.; Stehmann, J.R.; Baumgratz, J.F.A.; Pirani, J.R.; Sylvestre, L.; Maia, L.C.; Lohmann, L.G.; Queiroz, L.P.; Silveira, M.; Coelho, M.N.; Mamede, M.C.; Bastos, M.N.C.; Morim, M.P.; Barbosa, M.R.; Menezes, M.; Hopkins, M.; Secco, R.; Cavalcanti, T.B.; Souza, V.C. 2010. Introdução. in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro.
Oecologia Australis. Disponível em:
http://www.oecologiaaustralis.org/ojs/index.php/oa/article/view/12
SEADE - Fundação Sistema Estadual de Análise de Dados. Disponível em: www.seade.gov.br.
SIGRH - Sistema Integrado de Gerenciamento de Recursos Hídricos de São Paulo. Disponível em: http://www.sigrh.sp.gov.br/sigrh/basecon/r0estadual/capitulo04.htm.
Specieslink. Disponível em:
http://www.specieslink.org.br.
ANEXO I. Vegetação
Tabela 1. Compilação de espécies coletadas no município de Guarujá (SP) e depositadas em herbários oficiais (Herb). BHCB: Herbário da Universidade Federal de Minas Gerais; CEPEC: Herbário do Centro de Pesquisas do Cacau (BA); ESA: Herbário da Escola Superior de Agricultura - USP; FUEL: Universidade Estadual de Londrina (PR); HSJRP: Herbário de São José do Rio Preto; HUEFS: Herbário da Universidade Estadual de Feria de Santana (BA); HUEM; IAC: Herbário do Instituto Agronômico de Campinas; INPA: Instituto de Pesquisas da Amazônia (AM); JBRJ-RB: Jardim Botânico do Rio de Janeiro; MBM: Herbário do Museu Botânico Municipal (Curitiba, PR); SP: Coleção de Fanerógamas do Herbário do Estado “Maria Eneyda P. Kaufmann Fidalgo” (Instituto de Botânica, SP); SPF: Herbário do Departamento de Botânica, USP; SPSF: Herbário Dom Bento Pickel (IF, SP); UEC: Universidade Estadual de Campinas; UFP: Herbário Geraldo Mariz” – Universidade Federal do Paraná. Fonte: www.specieslink.org.br (consultado em 11/10/2011). Espécie ameaçada de extinção - SP: estado de São Paulo (SMA), BR: Brasil (IBAMA) e IUCN: International Union for Conservation of Nature. EN: em perigo; VU: vulnerável, EX: presumivelmente extinta, N: não são mencionadase SI: sem informação.
| Herb | Nome científico | Família | Reg. | Extinção | Localidade | ||
| SP | BR | IUCN | |||||
| ESA | Aphelandra prismatica | Acanthaceae | 69384 | N | N | N | |
| UEC | Mendoncia | Acanthaceae | 53049 | SI | SI | SI | Ilha de Guarujá |
| ESA | Pseuderanthemum atropurpureum | Acanthaceae | 98706 | N | N | N | |
| IAC | Cyathula | Amaranthaceae | 22922 | SI | SI | SI | |
| IAC | Gomphrena virgata | Amaranthaceae | 22928 | N | N | N | Comunidade na Região |
| UEC | Bomarea | Amaryllidaceae | 54728 | SI | SI | SI | |
| UEC | Schinus | Anacardiaceae | 056180 | SI | SI | SI | Mata Atlântica |
| UEC | Schinus | Anacardiaceae | 057917 | SI | SI | SI | Próximo à balsa de Bertioga.-Mata atlântica. |
| SPF | Schinus terebinthifolius | Anacardiaceae | 84170 | N | N | N | Ilha de Sto Amaro-Praia de Iporanga. |
| SPF | Schinus terebinthifolius var. rhoifolius | Anacardiaceae | 86488 | N | N | N | Ilha de Sto Amaro-Praia de Iporanga. |
| UEC | Tapirira | Anacardiaceae | 49999 | SI | SI | SI | rodovia Guarujá-Bertioga-Km 19, trilha da Prainha Branca, em mata. |
| UEC | Annona glabra | Annonaceae | 54749 | N | N | N | |
| UEC | Annona glabra | Annonaceae | 56269 | N | N | N | Mata de encosta, próximo ao pier. |
| MBM | Annona glabra | Annonaceae | 159290 | N | N | N | |
| UEC | Xylopia | Annonaceae | 54731 | SI | SI | SI | |
| UEC | Xylopia langsdorfiana | Annonaceae | 54739 | N | N | N | |
| IAC | Apiaceae(=Umbelliferae) | Apiaceae | 6077 | SI | SI | SI | Santos |
| NYBG_BR | Allamanda cathartica L. | Apocynaceae | 440190 | N | N | N | Ilha de Santo Amaro, between km 18 and 19 on highway from Guarujá to Bertioga, NE Santos |
| UEC | Temnadenia odorifera | Apocynaceae | 53294 | N | N | N | Mata de encosta |
| UEC | Ilex | Aquifoliaceae | 51646 | SI | SI | SI | |
| SP | Geonoma elegans | Arecaceae | 39268 | N | N | N | |
| SP | Geonoma elegans | Arecaceae | 39268 | N | N | N | |
| NYBG_BR | Aristolochia trilobata L. | Aristolochiaceae | 454172 | N | N | N | Guarujá, praia do Perequê |
| UEC | Asclepias | Asclepiadaceae | 53044 | SI | SI | SI | Mata Altântica, Ilha Guarujá |
| UEC | Asclepias curassavica | Asclepiadaceae | 51647 | N | N | N | Mata Atlântica de Encosta, solo pedregoso |
| UEC | Asclepias curassavica | Asclepiadaceae | 56892 | N | N | N | |
| UEC | Asclepias curassavica | Asclepiadaceae | 59851 | N | N | N | Ilha de Guarujá |
| NYBG_BR | Baccharis cassinifolia DC. | Asteraceae | 787851 | N | N | N | |
| JBRJ_RB | Piptocarpha | Asteraceae | 355393 | SI | SI | SI | |
| NYBG_BR | Wulffia stenoglossa DC. | Asteraceae | 804474 | N | N | N | Galhetas |
| UEC | Jacaranda puberula | Bignoniaceae | 49995 | N | N | N | rodovia Guarujá-Bertioga-Km 19, trilha Prainha Branca. |
| FUEL | Jacaranda puberula | Bignoniaceae | 5477 | N | N | N | Rodovia Guarujá-Bertioga, Km19 |
| JBRJ_RB | Cordia curassavica (Jacq.) Roem. & Schult. | Boraginaceae | 4370 | N | N | N | |
| ESA | Cleome | Brassicaceae | 66249 | SI | SI | SI | |
| JBRJ_RB | Aechmea nudicaulis var. cuspidata Baker | Bromeliaceae | N | N | N | ||
| JBRJ_RB | Bromelia antiacantha Bertoloni | Bromeliaceae | N | N | N | ||
| UEC | Canna | Cannaceae | 45240 | SI | SI | SI | Rodovia Guarujá-Bertioga km 19-trilha da prainha branca |
| ESA | Clusia | Clusiaceae | 69383 | SI | SI | SI | |
| ESA | Tradescantia | Commelinaceae | 69120 | SI | SI | SI | |
| HUEM | Ipomoea | Convolvulaceae | SI | SI | SI | ||
| UEC | Ipomoea tiliacea | Convolvulaceae | 54229 | N | N | N | Ilha de Guarujá |
| SP | Thoracocarpus bissectus | Cyclanthaceae | 29668 | N | N | N | Ilha de Santo Amaro |
| SP | Thoracocarpus bissectus | Cyclanthaceae | 39269 | N | N | N | |
| UFP | Androtrichum polycephalum | Cyperaceae | 35310 | N | N | N | |
| UFP | Fimbristylis glomerata | Cyperaceae | 39322 | N | N | N | |
| UFP | Fimbristylis spadicea | Cyperaceae | 42323 | N | N | N | |
| NYBG_BR | Pleurostachys graminifolia Brongn. | Cyperaceae | 636557 | N | N | N | |
| CEPEC | Davilla rugosa | Dilleniaceae | 51044 | N | N | N | Sem informaç?o. |
| UEC | Dioscorea monadelpha | Dioscoreaceae | 053276 | N | N | N | Mata de encosta |
| UEC | Dioscorea monadelpha | Dioscoreaceae | 053285 | N | N | N | Mata de encosta |
| UEC | Dioscorea monadelpha | Dioscoreaceae | 056273 | N | N | N | Mata de encosta próximo ao Pier. |
| SP | Acalypha wilkesiana | Euphorbiaceae | 34348 | N | N | N | |
| UEC | Croton macrobothrys | Euphorbiaceae | 50002 | N | N | N | Rodovia GUarujá - Bertioga, km 19, trilha |
| UEC | Croton macrobothrys | Euphorbiaceae | 53282 | N | N | N | Mata de encosta |
| SP | Croton macrobothrys | Euphorbiaceae | 316668 | N | N | N | Rod. Guarujá-Bertioga, Km 19, trilha Prainha Branca, em mata. |
| UEC | Dalechampia | Euphorbiaceae | 49994 | SI | SI | SI | rodovia Guarujá-Bertioga-km 19, trilha Prainha Branca, mata |
| UEC | Dalechampia | Euphorbiaceae | 53292 | SI | SI | SI | Mata de encosta |
| UEC | Dalechampia | Euphorbiaceae | 54733 | SI | SI | SI | |
| SP | Dalechampia | Euphorbiaceae | 316667 | SI | SI | SI | Rodovia Guarujá-Bertioga, Km 19, trilha Prainha Branca, mata. |
| JBRJ_RB | Dalechampia | Euphorbiaceae | 318626 | SI | SI | SI | |
| INPA | Dalechampia | Euphorbiaceae | 172206 | SI | SI | SI | Reserva Florestal Ducke, Q.2, próximo a árvore n? 200. Mata de terra firme, solo argiloso. |
| FUEL | Dalechampia | Euphorbiaceae | 17741 | SI | SI | SI | Trilha p. Prainha Branca,junto a balsa Guaruja-Bertioga Prainha Branca |
| SPF | Dalechampia reitzkleinii | Euphorbiaceae | 150611 | N | N | N | Guarujá/Bertioga, trilha para a Prainha Branca, junto a balsa. Mata atlântica de encosta. |
| SP | Dalechampia reitzkleinii | Euphorbiaceae | 254451 | N | N | N | Bertioga. Trilha para a Prainha Branca, junto a balsa Guarujá-Bertioga. Mata Atlântica de encosta |
| UEC | Dalechampia scandens | Euphorbiaceae | 82340 | N | N | N | Trilha da Prainha Branca, em mata. |
| IAC | Manihot | Euphorbiaceae | 6078 | SI | SI | SI | |
| SP | Manihot inflata | Euphorbiaceae | 44810 | N | N | N | Galhetas |
| SPF | Microstachys corniculata | Euphorbiaceae | 86490 | N | N | N | Ilha de Santo Amaro. Praia de Iporanga. |
| MBM | Tetrorchidium rubrinervium | Euphorbiaceae | 159226 | N | N | N | |
| UEC | Tetrorchidium rubrivenium | Euphorbiaceae | 50001 | N | N | N | Rodovia Guarujá-Bertioga, km 19, trilha |
| ESA | Dalbergia | Fabaceae | 11003 | SI | SI | SI | |
| NYBG_BR | Desmodium axillare (Sw.) DC. var. acutifolium (Kuntze) Urb. | Fabaceae | 594241 | N | N | N | Guarujá |
| UEC | Stenotaphrum secundatum | Gramineae | 25033 | N | N | N | Praia da Enseada |
| UEC | Calophyllum | Guttiferae | 45246 | SI | SI | SI | Rod. Guarujá-Bertioga, km19, trilha da Prainha Branca |
| UEC | Clusia criuva ssp. parviflora | Guttiferae | 53048 | N | N | N | |
| UEC | Clusia criuva ssp. parviflora | Guttiferae | 56291 | N | N | N | |
| ESA | Heliconia | Heliconiaceae | 3970 | SI | SI | SI | |
| UEC | Heliconia velloziana | Heliconiaceae | 45238 | N | N | N | Trilha da Prainha Branca. |
| JBRJ_RB | Lacistema | Lacistemataceae | 318604 | SI | SI | SI | |
| SP | Abarema brachystachya | Leguminosae | 29604 | N | N | N | Ilha de Santo Amaro |
| SP | Aeschynomene elegans | Leguminosae | 34343 | N | N | N | |
| SP | Cassia tetraphylla var. littoralis | Leguminosae | 13221 | N | N | N | |
| SP | Chamaecrista flexuosa var. flexuosa | Leguminosae | 13184 | N | N | N | |
| SP | Dalbergia ecastaphyllum | Leguminosae | 13371 | N | N | N | |
| SP | Desmodium axillare | Leguminosae | 39263 | N | N | N | |
| SP | Inga sellowiana | Leguminosae | 7037 | N | N | N | |
| SP | Pithecellobium | Leguminosae | 28064 | SI | SI | SI | |
| SP | Pithecellobium | Leguminosae | 85037 | SI | SI | SI | Ilha de Sto Amaro, Pedra de Iporanga |
| SP | Stylosanthes viscosa | Leguminosae | 28462 | N | N | N | Ilha de Santo Amaro |
| SP | Vigna longifolia | Leguminosae | 13479 | N | N | N | |
| JBRJ_RB | Mucuna urens (L.) Medik. | Leguminosae-Pap. | 409858 | N | N | N | |
| UEC | Inga laurina | Leguminosae-mim | 53297 | N | N | N | Mata de encosta. |
| UEC | Inga laurina | Leguminosae-mim | 54746 | N | N | N | |
| UEC | Dahlstedtia pentaphylla | Leguminosae-pap | 50004 | N | N | N | Rodovia Guarujá-Bertioga, km 19, trilha |
| FUEL | Dahlstedtia pentaphylla | Leguminosae-pap | 13629 | N | N | N | Rodovia Guaruja, km19, trilha da Prainha Branca |
| UEC | Dalbergia frutescens | Leguminosae-pap | 54758 | N | N | N | |
| UEC | Swartzia langsdorffii | Leguminosae-pap | 45241 | N | N | N | Rodovia GUarujá - Bertioga, km 19, trilha da Prainha Branca |
| UEC | Vigna longifolia | Leguminosae-pap | 069391 | N | N | N | Ex. Herb. Polyt. de S?o Paulo. |
| SP | Niedenzuella mogoriifolia | Malpighiaceae | 34347 | N | N | N | |
| UEC | Stigmaphyllon | Malpighiaceae | 53279 | SI | N | N | |
| NYBG_BR | Stigmaphyllon arenicola C. E. Anderson | Malpighiaceae | 476302 | N | N | N | Ilha de Sto Amaro, between km 18 and 19 on highway Guaruja -Bertioga, n.e. of Santos |
| SPSF | Hibiscus bifurcatus | Malvaceae | 04114 | EN | N | N | Ilha de Santo Amaro |
| UEC | Sida | Malvaceae | 56289 | SI | SI | SI | |
| ESA | Leandra | Melastomataceae | 69719 | SI | SI | SI | |
| UEC | Miconia cabucu | Melastomataceae | 45249 | N | N | N | Trilha da Prainha Branca. |
| UEC | Miconia cinnamomifolia | Melastomataceae | 49991 | N | N | N | Rodovia Guarujá-Bertioga, km 19 - Trilha |
| MBM | Miconia cinnamomifolia | Melastomataceae | 159246 | N | N | N | |
| JBRJ_RB | Miconia cinnamomifolia (DC.) Naudin | Melastomataceae | 317806 | N | N | N | |
| IAC | Miconia dodecandra | Melastomataceae | 24844 | N | N | N | Rodovia Guarujá-Bertioga |
| UEC | Miconia prasina | Melastomataceae | 45242 | N | N | N | Rodovia Guarujá-Bertioga, km 19 - Trilha |
| UEC | Miconia prasina | Melastomataceae | 49996 | N | N | N | Rodovia Guarujá-Bertioga, km 19 - Trilha |
| UEC | Miconia prasina | Melastomataceae | 54738 | N | N | N | |
| MBM | Miconia prasina | Melastomataceae | 159245 | N | N | N | |
| NYBG_BR | Tibouchina arborea (Gardner) Cogn. | Melastomataceae | 523008 | N | N | N | Guarujá, by the sea near Santos |
| MBM | Tibouchina pulchra | Melastomataceae | 82998 | N | N | N | |
| UEC | Cissampelos andromorpha | Menispermaceae | 053290 | N | N | N | Mata da Encosta. |
| UEC | Cissampelos andromorpha | Menispermaceae | 056271 | N | N | N | Mata da encosta próximo pier. |
| CEPEC | Cissampelos andromorpha | Menispermaceae | 51045 | N | N | N | Sem informaç?o. |
| NYBG_BR | Zygia selloi (Benth.) L. Rico | Mimosaceae | 459666 | N | N | N | Ilha de Sto. Amaro. Mata |
| INPA | Mollinedia | Monimiaceae | 172207 | SI | SI | SI | Mata de encosta |
| ESA | Mollinedia cyathantha | Monimiaceae | 69145 | EX | N | N | |
| UEC | Mollinedia schottiana | Monimiaceae | 053287 | N | N | N | Mata de encosta. |
| UEC | Mollinedia schottiana | Monimiaceae | 056278 | N | N | N | Mata Atlântica. |
| UEC | Siparuna brasiliensis | Monimiaceae | 054729 | N | N | N | |
| UEC | Siparuna brasiliensis | Monimiaceae | 056267 | N | N | N | Mata de encosta, próximo pier. |
| MBM | Siparuna brasiliensis | Monimiaceae | 159252 | N | N | N | |
| JBRJ_RB | Siparuna brasiliensis (Spreng.) A.DC. | Monimiaceae | 320626 | N | N | N | |
| SPSF | Coussapoa microcarpa | Moraceae | 17491 | N | N | N | Ilha Santo Amaro |
| HSJRP | Ficus | Moraceae | 09900 | SI | SI | SI | Guarujá |
| UEC | Ficus organensis | Moraceae | 54726 | N | N | N | |
| JBRJ_RB | Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. | Myrsinaceae | 320602 | N | N | N | |
| UEC | Rapanea ferruginea | Myrsinaceae | 54754 | N | N | N | |
| UEC | Rapanea ferruginea | Myrsinaceae | 56099 | N | N | N | Ilha do Guarujá |
| IAC | Rapanea ferruginea | Myrsinaceae | 46724 | N | N | N | Vila Zilda, morro da Asa Delta |
| SP | Eugenia | Myrtaceae | 335824 | SI | SI | SI | Estrada Guarujá-Bertioga, km 17,5 |
| IAC | Eugenia | Myrtaceae | 46721 | SI | SI | SI | Praia de Pernambuco, morro no canto direito |
| SP | Eugenia brasiliensis | Myrtaceae | 339248 | VU | N | N | Ilha de Sto. Amaro, Praia da Armação. |
| SP | Eugenia ligustrina | Myrtaceae | 316676 | N | N | N | Rod. Guarujá-Bertioga, mata. |
| SPSF | Eugenia schuchiana | Myrtaceae | 19080 | N | N | N | Condomínio Jardim Acapulco |
| UEC | Eugenia sulcata | Myrtaceae | 50003 | N | N | N | Rodovia Guarujá-Bertioga Km 19-trilha Prainha Branca, mata. |
| CEPEC | Eugenia sulcata | Myrtaceae | 115220 | N | N | N | Rod. Guarujá/Bertioga, KM 19 trilha da Prainha Branca. |
| JBRJ_RB | Eugenia sulcata Spring ex Mart. | Myrtaceae | 318609 | N | N | N | |
| SP | Marlierea tomentosa | Myrtaceae | 65923 | N | N | N | Rodovia Guarujá-Bertioga. No bordo da mata secundária. |
| SP | Myrcia hebeclada | Myrtaceae | 7343 | N | N | N | |
| SP | Myrcia multiflora | Myrtaceae | 39250 | N | N | N | |
| NYBG_BR | Myrcia pubipetala Miq. | Myrtaceae | 616405 | N | N | N | |
| JBRJ_RB | Myrcia pubipetala Miq. | Myrtaceae | 374848 | N | N | N | |
| JBRJ_RB | Psidium cattleyanum (Kiaersk.) | Myrtaceae | 317785 | N | N | N | |
| JBRJ_RB | Guapira opposita (Vell.) Reitz | Nyctaginaceae | 282276 | N | N | N | |
| UEC | Ouratea | Ochnaceae | 38430 | SI | SI | SI | Trilha da Prainha Branca em mata. |
| SPSF | Ouratea | Ochnaceae | 44640 | SI | SI | SI | Rodovia Guarujá-Bertioga |
| SP | Pleurothallis guarujaensis | Orchidaceae | 39228 | N | N | N | Ilha de Santo Amaro, praia das Tartarugas |
| UEC | Oxalis | Oxalidaceae | 056247 | SI | SI | SI | Próximo ao píer-Mata de encosta. |
| UEC | Oxalis | Oxalidaceae | 45239 | SI | SI | SI | Trilha da Prainha Branca, mata. |
| SP | Oxalis cytisoides | Oxalidaceae | 254450 | N | N | N | Trilha para a Prainha Branca, junto á balsa Guarujá-Bertioga |
| IAC | Passiflora amethystina | Passifloraceae | 46725 | N | N | N | Astúrias, morro do Pitu |
| IAC | Passiflora amethystina | Passifloraceae | 49357 | N | N | N | Vicente de Carvalho, Vila Zilda, morro das antenas, beira da estrada. |
| IAC | Passiflora capsularis | Passifloraceae | 49356 | N | N | N | Vicente de Carvalho, Vila Zilda, morro das antenas, beira da estrada. |
| IAC | Passiflora edulis | Passifloraceae | 37580 | N | N | N | Próximo da praia de Pernambuco, entre o costão e a mata no morro |
| IAC | Passiflora edulis | Passifloraceae | 38097 | N | N | N | Jardim Acapulco 4 |
| IAC | Passiflora foetida | Passifloraceae | 46722 | N | N | N | Vila Zilda, morro da Asa Delta |
| IAC | Passiflora jilekii | Passifloraceae | 46723 | N | N | N | Vila Zilda, morro da Asa Delta |
| UEC | Ottonia | Piperaceae | 58660 | SI | SI | SI | Ilha do Guarujá |
| UEC | Ottonia | Piperaceae | 59724 | SI | SI | SI | Mata de encosta |
| UEC | Ottonia | Piperaceae | 82310 | SI | SI | SI | Mata de encosta |
| JBRJ_RB | Ottonia | Piperaceae | 320596 | SI | SI | SI | |
| FUEL | Ottonia | Piperaceae | 13650 | SI | SI | SI | Mata da Encosta |
| UEC | Piper | Piperaceae | 54232 | SI | SI | SI | Ilha de Guarujá |
| MBM | Piper corcovadensis | Piperaceae | 159241 | N | N | N | |
| JBRJ_RB | Piper corcovadensis (Miq.) C. DC. | Piperaceae | 347568 | N | N | N | |
| FUEL | Piper hayneanum | Piperaceae | 13650 | N | N | N | Mata da Encosta |
| NYBG_BR | Cortaderia rudiuscula Stapf | Poaceae | 651058 | N | N | N | |
| SP | Ischaemum minus | Poaceae | 9599 | N | N | N | |
| ESA | Coccoloba | Polygonaceae | 69136 | SI | SI | SI | |
| UEC | Coccoloba declinata | Polygonaceae | 55038 | N | N | N | Mata Atlântica. |
| UEC | Coccoloba declinata | Polygonaceae | 57900 | N | N | N | Próximo à bolsa de Bertioga |
| UEC | Coccoloba declinata | Polygonaceae | 58037 | N | N | N | Mata Atlântica |
| HSJRP | Campyloneurum rigidum | Polypodiaceae | 24932 | N | N | N | Ilha de Santo Amaro, praia Iporanga |
| UEC | Roupala paulensis | Proteaceae | 45245 | N | N | N | Rodovia Guarujá-Bertioga, km 19-Trilha da Prainha Branca |
| NYBG_BR | Lycopodium complanatum L. | Pteridophyte | 788934 | N | N | N | |
| NYBG_BR | Pecluma paradiseae (Langsd. & Fisch.) Price | Pteridophyte | 679165 | N | N | N | |
| ESA | Bathysa | Rubiaceae | 13153 | SI | SI | SI | |
| JBRJ_RB | Bathysa mendoncaei K.Schum. | Rubiaceae | 320603 | N | N | N | |
| IAC | Borreria ocimifolia | Rubiaceae | 22916 | N | N | N | |
| IAC | Borreria ocimifolia | Rubiaceae | 22917 | N | N | N | |
| SP | Coccocypselum capitatum | Rubiaceae | 41844 | N | N | N | Ilha de Santo Amaro |
| IAC | Diodia apiculata | Rubiaceae | 22915 | N | N | N | Praia da Enseada |
| JBRJ_RB | Psychotria | Rubiaceae | 381016 | SI | SI | SI | |
| ESA | Psychotria leiocarpa | Rubiaceae | 69668 | N | N | N | |
| MBM | Psychotria officinalis | Rubiaceae | 56468 | N | N | N | |
| IAC | Rubiaceae | Rubiaceae | 46720 | SI | SI | SI | Praia de Pernambuco, morro no canto direito |
| UEC | Metrodorea nigra | Rutaceae | 54233 | N | N | N | Ilha do Guarujá |
| UEC | Metrodorea nigra | Rutaceae | 54745 | N | N | N | |
| ESA | Cupania | Sapindaceae | 69462 | SI | SI | SI | |
| UEC | Cupania furfuracea | Sapindaceae | 50005 | EN | N | N | Rodovia Guarujá - Bertioga Km 19-Trilha da prainha branca. |
| JBRJ_RB | Cupania furfuracea Radlk. | Sapindaceae | 318625 | EN | N | N | |
| UEC | Cupania oblongifolia | Sapindaceae | 50000 | N | N | N | Rodovia Guarujá - Bertioga Km 19-Trilha da Prainha Branca. |
| SPSF | Paullinia trigonia | Sapindaceae | 04115 | N | N | N | Ilha de Santo Amaro |
| SPSF | Serjania piscatoria | Sapindaceae | 33173 | N | N | N | |
| CEPEC | Serjania piscatoria | Sapindaceae | 101603 | N | N | N | Sem informaç?o. |
| JBRJ_RB | Chrysophyllum | Sapotaceae | 409339 | SI | N | N | |
| HUEFS | Chrysophyllum flexuosum | Sapotaceae | 68204 | N | N | N | |
| JBRJ_RB | Chrysophyllum flexuosum Mart. | Sapotaceae | 376238 | N | N | N | |
| ESA | Solanaceae | Solanaceae | 69748 | SI | SI | SI | |
| JBRJ_RB | Solanum pseudoquina A.St.-Hil. | Solanaceae | 318595 | N | N | N | |
| UEC | Trigonia | Trigoniaceae | 150487 | SI | SI | SI | Rodovia Guarujá - Bertioga Km 19-Trilha da Prainha Branca. |
| UEC | Trema micrantha | Ulmaceae | 53280 | N | N | N | |
| INPA | Trema micrantha | Ulmaceae | 172208 | N | N | N | |
| UEC | Umbelliferae | Umbelliferae | 56272 | SI | SI | SI | Próximo ao píer. |
| UEC | Aegiphila integrifolia | Verbenaceae | 82311 | N | N | N | |
| UEC | Citharexylum | Verbenaceae | 45247 | SI | SI | SI | Rodovia Guarujá - Bertioga, Km 19. Trilha da Prainha Branca. |
| UEC | Citharexylum | Verbenaceae | 53283 | SI | SI | SI | |
| NYBG_BR | Lantana undulata Schrank | Verbenaceae | 570689 | N | N | N | Guarujá |
| JBRJ_RB | Lantana undulata Schrank | Verbenaceae | 370481 | N | N | N | |
| JBRJ_RB | Verbenaceae | Verbenaceae | 317802 | SI | SI | SI | |
| UEC | Vitex polygama | Verbenaceae | 56266 | N | N | N | Mata de encosta Próx ao Pier. |
ANEXO II. Mapas Temáticos da Serra do Guararu
Mapa-base (Articulação)
3.24 MB
| Mapa-base Folha 01 de 08
| Mapa-base Folha 02 de 08
| Mapa-base Folha 03 de 08
| Mapa-base Folha 04 de 08
|
| Mapa-base Folha 05 de 08
| Mapa-base Folha 06 de 08
| Mapa-base Folha 07 de 08
| Mapa-base Folha 08 de 08
|
Mapa Geológico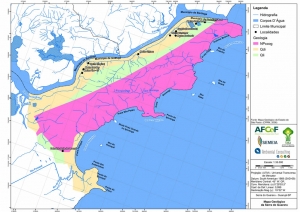
2.73 MB
- Mapa Hipsométrico – folhas 01 a 08
| Mapa Hipsométrico
| Mapa Hipsométrico
| Mapa Hipsométrico
| Mapa Hipsométrico
|
| Mapa Hipsométrico
| Mapa Hipsométrico
| Mapa Hipsométrico
| Mapa Hipsométrico
|
Mapa Hidrográfico
2.64 MB
- Mapa de Vegetação – folhas 01 a 08
| Mapa de Vegetação
| Mapa de Vegetação
| Mapa de Vegetação
| Mapa de Vegetação
|
| Mapa de Vegetação
| Mapa de Vegetação
| Mapa de Vegetação
| Mapa de Vegetação
|
- Mapa de Unidades de Conservação
Mapa de Unidades de Conservação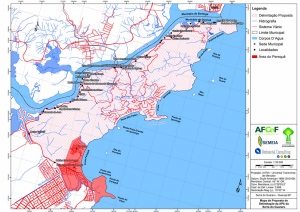
6.78 MB
- Mapa de Uso e Ocupação do Solo – folhas 01 a 08
| Mapa de Uso e
| Mapa de Uso e
| Mapa de Uso e
| Mapa de Uso e
|
| Mapa de Uso e
| Mapa de Uso e
| Mapa de Uso e
| Mapa de Uso e
|